전기 영동법
1. Polyacrylamide gel
1-1. SDS - polyacrylamide gel 전기 영동 (SDS-PAGE)
정제과정에서 단백질의 순도 검정에는 SDS - polyacrylamide gel 전기영동법 (SDS - PAGE) 이 가장 널리 이용되고 있다. SDS - PAGE에서는 작은 단백질일수록 빨리 이동하기 때문에 분자량 marker 와 비교함으로서, 비로소 분자량의 추정이 가능하다.
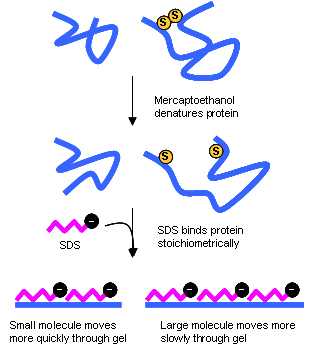
SDS - PAGE를 행하기 위하여서는 우선, sample에 Sodium dodecylsulfate (SDS) 와 2-Mercaptoethanol 등을 가하여 끓인다. SDS는 음이온성의 계면 활성제로서, 단백질을 강력하게 변성시키면서 동시에 소수성의 부분 단백질의 주쇄 (backbone) 와 결합한다. 그리고, 2-Mercaptoethanol은 S-S 결합을 환원하면서 절단한다. 그 결과, 단백질은 완전히 변성하고, 복수의 subunit로부터 되어지는 경우는 해리되고, 전체가 거의 균일하게 부의 전하를 받게 되는 상태가 된다.
SDS의 구조 : CH3(CH2)11SO3Na
이것을 polyacrylamide gel 중에서 전기 영동하면, 원칙적으로 단백질의 형태나 성질에 관계없이 gel의 분자효과와 전하의 효과에 의해서 분자량에 따라서 분리가 가능해진다. 만약, 막 단백질, 당 단백질, 인산화 단백질, proline이 많은 단백질 등에서는 SDS 결합량이 보통의 단백질과 약간 틀리기 때문에 SDS-PAGE 상에서 보여지는 분자량은 실제의 분자량과 다소 차이가 나는 경우가 있다.
단백질의 이동도는, gel의 "경도"에도 의존하기 때문에 목적하는 단백질 분자량에 반하여 적당한 gel을 만들어 사용한다. Acrylamide의 농도를 높이 할수록 경도가 높아진다.
경도가 높은 gel은, 즉 편목 구조가 적어지고, 작은 단백질을 분리하는데는 적당한 gel이 될 수 있다. 분자량에 관한 정보가 전혀 없을 경우에는, 10~20% gel을 사용하고 분자량 20000부터 200000 정도의 단백질을 1매의 gel에서 검출하는 것이 가능하다. Acrylamide의 농도 구배를 이용한 gel (gradient gel) 을 사용하는 방법도 있다.
SDS - PAGE
준비물
1) Mini gel용 전기 영동장치의 순서
- 영동조
- 영동판 (glass제, 100*100mm 정도) 및 gel 두께가 1mm 정도 되게 space를 붙일 수 있는 것
- 영동판용 packing, 또는 silicon tube (No. 0)
- Comb (polyethylene제, 두께 1mm, 10~16 well)
- Clip (gel 1매당 4개)
- 전원 (정전류로서 20~100mA로 조절할 수 있는 것, 전기영동장치의 maker로부터 시판되고 있음)
- 50ul hamilton syringe (sample apply 용, pipettman도 가능)
- 5ml syringe와 19~24G의 주사침 (gel판 하단의 공기를 제거할 때 사용)
2) 시약류
- 30% Acrylamide mixture
- 0.75M Tris-HCl (pH 8.8)
- 0.25M Tris-HCl (pH 6.8)
- 10% SDS
- N, N, N', N' - Tetramethylethylenediamune (TEMED)
- 25% APS (Ammonium persulfate)
- 분자량 marker
- 2*sample buffer
- 영동 buffer
3) 시약의 조제
30% acrylamide mixture
Acrylamide - 73g (최종농도 ; 29.2%)
N-N'- Methylenebisacrylamide - 2g (0.8%)
-> DW를 가하여 total 250ml이 되게 한다. 차광하여 냉장보존. 미중합의 acrylamide는 신경독이 있는 것으로 알려져 있으며, 손으로 직접 만지지 말 것
- 가호제는 N-N'-Methylenebisacrylamide 가 가장 일반적이지만 다른 것도 있음. 예를 들면 Piperazine diacrtlamide (Bio-Rad사) 는 gel의 강도가 높은 것이 있기 때문에 최근에 간혹 사용됨
0.75M Tris-HCl (pH 8.8)
Tris base - 90.75g
-> DW를 첨가하여 약 800ml이 되게 하고, 실온에서 6N HCl로서 pH를 8.8 에 맞춘 후 1L 이 되게 mess up 한다. 냉장보존
0.25M Tris-HCl (pH 6.8)
Tris base - 30.25g
-> DW를 첨가하여 약 800ml이 되게 하고, 실온에서 6N HCl로서 pH를 6.8 에 맞춘 후 1L 이 되게 mess up 한다. 냉장보존
- Tris buffer는 온도에 의해서 pH가 변한다. SDS - PAGE는 실온에서 행하기 때문에 pH의 조정은 실온에서 행할 것. pH를 맞출 대 중화열에서 액온이 상승하면, 일단 pH를 맞춘 후 실온에서 방치하고 한 번 더 정확하게 pH를 맞춘 후 mess-up한다.
- Tris buffer는 온도에 의해서 pH가 변한다. SDS - PAGE는 실온에서 행하기 때문에 pH의 조정은 실온에서 행할 것. pH를 맞출 대 중화열에서 액온이 상승하면, 일단 pH를 맞춘 후 실온에서 방치하고 한 번 더 정확하게 pH를 맞춘 후 mess-up한다.
10% SDS
SDS - 10g (10%)
-> DW를 첨가하여 total 100ml 이 되게 한다. 실온 보존.
25% APS
Ammonium Persulfate - 250mg (25%)
DW - 1ml
total - 약 1ml
-> 차광하여 냉장 보존에서 3~4 주간 사용 가능
2X sample buffer
0.25M Tris-HCl (pH 6.8) - 25ml (0.125M)
2-Mercaptoethanol - 5ml (10%)
SDS - 2g (4%)
Sucrose - 5g (10%)
Bromophenol blue - 2ug (0.004%)
-> DW를 가하여 total 50ml 이 되게 한다. 냉장 보존. (장기간 보존할 경우는 2-Mercaptoethanol을 넣어서 보존하는 것이 바람직하다.
10X 영동 buffer
Tris base - 30.3g (250mM)
Glycine - 144g (1.92M)
SDS - 10g (1%)
-> DW를 가하여 total 1L이 되게 한다. 실온 보존.
영동 buffer
10X Running buffer - 100ml
DW - 900ml
total - 1L
-> 실온 보존.