면역 침강법
면역침강법(immunoprecipitation)은 항체와 항원의 친화성을 이용하여, 용액으로부터 항원 (또는 항원과 친화성을 가진 물질)을 특이적으로 분리한다. 침강시키는 방법으로 생체내 미량성분의 검출이나 분자간의 상호작용을 간단히 검색하는 방법으로서 널리 이용되고 있다. 특히 면역 침강법을 단백질표식 (RI 표식, biotin 표식 등), 세포의 분획법, SDS-PAGE, 및 Western blotting법 등과 재조합 (recombinant) 함으로써 목적 단백질의 생합성 과정이나 대사 경로를 반정량적으로 조사하는 것이 가능하다.
면역 침강법에서 가장 중요한 point는 이용하는 항체의 물질로서 항체에 대한 특이성이 높고, 아주 높은 친화성으로 반응하는 항체를 선택하지 않으면 안된다. 특히 단백질의 부분 peptide를 화학적으로 합성하고, 거기에 대한 항체를 작성한 경우나 천연 단백질과는 다른 protein과 재조합 단백질을 항원으로서 이용한 경우, Western blotting에서 반응하는 것, 용액 중에서는 천연 단백질과 결합하지 않는 항체가 만들어져 있기 때문에 각각의 방법에서 항체의 성질을 조사하여 미리 check하여 둘 필요가 있다.
1. 일반적인 방법과 원리
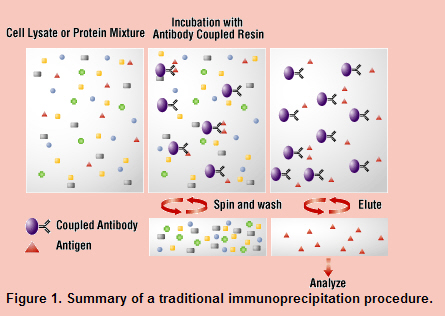
면역 침강법에서는 우선 1) 항원을 포함한 용액에 항체 (일차 항체)를 첨가하고, 용액중의 항원-항체 복합체를 형성시킨다. 다음으로 2) protein A 또는 항 IgG 항체 (이차 항체)를 agarose bead에 고상화한 것을 첨가하고, 생성된 복합체를 고상 (bead)에 흡착시킨다. 최후에 bead를 잘 washing한 후 3) 적당한 방법 (산 추출이나 SDS에 의한 추출)으로 bead로부터 항원을 추출하는 방법이다.
효율이 높은 항원을 침강시키기 위하여서는 항원, 일차 항체 및 이차 항체의 양의 비가 매우 중요하다. 일반적으로 항우너에 대한 친화성이 높은 monoclonal 항체를 일차 항체로서 이용한 경우에서는 항원 < 일차 항체 < 이차 항체의 량비로 하면 좋지만, polyclonal 항체를 이용한 다분자 복합체를 형성시킬 경우에는 양비를 변화시켜 최적 조건을 검색할 필요가 있다.
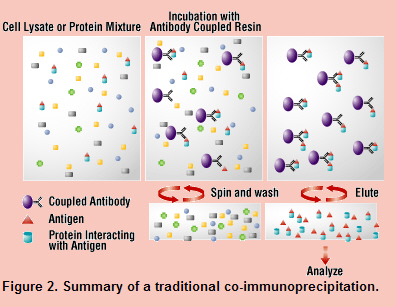
1) Monoclonal antibody를 이용할 경우
Monoclonal 항체는 일반적으로 항원 측의 한 종류와 반응부위 (epitope) 를 인식하기 때문에 한 분자의 항원에는 한 분자의 항체 밖에 결합되지 않는다. 그리고, 항원 - 항체 반응이 균일하기 때문에 Kd치를 정의하는 것이 가능하다. 반응용액 중의 일차항체 농도 Kd치보다 낮을 경우, 대부분의 항원이 항체와 복합체로 형성되어 있기 때문에 친화성이 높은 monoclonal 항체 (Kd < 10의 -8제곱M) 을 선택할 필요가 있다. 일차 항체 농도를 일단 올려보고, 이차 항체의 허용량을 초과하면 유리 (free) 의 일차 항체에 의하여 항원 - 항체 복합체와의 반응이 저해되어지기 때문에 주의하지 않으면 안된다.
2) Polyclonal antibody를 이용할 경우
Polyclonal 항체는 각각 종류의 항체 혼합물로서, 항원측의 반응부위도 친화성도 여러 종류이다. 그리고, 항원을 리간드로서 affinity chromatography로 정제하지 않는 이상 항원으로서는 친화성을 가지고 있지 않은 IgG 등이 포함되어 있다. Polyclonal 항체와 항원과의 반응은 다중가이기 때문에 복수의 항우너과 항체를 cross시키면 다분자복합체가 형성되어진다. 각각의 항원 - 항체 간의 결합이 약하더라도 다중가로 결합되어 있기 때문에 항원 - 항체 복합체는 안정되어 있다. 한편, 다분자복합체를 생기게 하는 항원과 항체의 양이 최적화일 경우, 과잉의 항체가 존재하게 되면 cross 형성은 저해되어지기도 한다. 그리고, 항체 내에는 특이성이 낮은 분자도 포함되어 있기 때문에 항원 이외의 물질이 다분자복합체 중에 혼입되어 있는 경우가 있으므로 background가 높에 나타나는 결점이 있다.
3) 여러 종의 monoclonal 항체를 혼합하여 사용하는 경우
특이성이 높은 monoclonal 항체를 여러 종류 혼합하는 것에 의하여 항원과 다중가로서 결합시키는 것이 가능하다. 여기서 사용하는 항원이 저친화성 항체라도 안정한 항원 - 항체 복합체를 형성시키는 것이 가능하다. 특이성이 낮은 항체를 포함하고 있지 않기 때문에 background가 높게 나타나는 것을 피할 수 있다.
4) 항원 - 항체 반응의 조건
면역침강에 있어서 항원 - 항체 반응을 행할 경우, 단백질끼리의 비특이적 상호작용 (정전적 상호작용이나 소수적 상호작용) 을 추구하기 위하여, 적당한 농도의 염과 중성계면 활성제를 첨가하는 것이 일반적이다. 항체에 따라서는 항원과의 친화성이 낮아지는 경우가 있으므로 미리 조사하여 둘 필요가 있다. 계면활성제의 첨가함에 의하여, rotation을 이용한 소량의 sample에 대하여 교반이 가능하다. 그리고, 세포 용해물이나 순화배지 (conditioned medium), 조직추출물 등을 시료로서 사용할 경우, 여기에 포함되어 있는 단백질분해효소 (protease) 에 의하여 항체 또는 항원이 분해되어지는 것을 막기 위하여 여러 종류의 protease inhibitor 를 첨가한다. Protease의 종류를 특정짓기 어려울 경우는 특이성이 광범위한 inhibitor (PMSF나 EDTA, 1,10-phenanthroline 등) 을 첨가한다. 또한 다음 과정에 장해를 주지 않는한 단백질 inhibitor (protein이나 histidine) 를 첨가하여도 좋다. 이외, 항원 - 항체 반응의 과정에서 여러 종류의 효소반응 (인산이나 탈인산화) 이 진행되지 않게 효소에 대한 inhibitor를 첨가하는 경우도 있다.
<표> 저분자량 protease inhibitor와 저해양식
| inbitor 명 | 분자량 | 특이성 | 저해양식 | 유해농도 | 보존용액 (안정성) |
| Antipain | 604.7 | trypsin형 serine protease 일부의 cystein protease |
가역성 | 1~10uM | 10mM 수용액 (4도씨에서 1주간, -20도씨에서 1개월간 안정) |
| p-APMSF | 216.2 | trypsin형 serine protease | 불가역성 | 10~100uM | 50mM 수용액 (사용할 때 제조) |
| Chymostatin | 604.7 | chymotrypsin형 serine 일부는 cystein protease |
가역성 | 10~100uM | 10mM DMSO 용액 (-20도씨에서 수개월 안정) |
| DFP | 184.2 | serin protease 전반 | 불가역성 | 0.1~1mM | 500mM 건조 isopropanol 용액 (-70도씨에서 수개월간 안정, 독성이 높음) |
| E-643 | 357.4 | cystein protease | 불가역성 | 1~10uM | 1mM 수용액 (-20도씨에서 수개월간 안정) |
| EDTA | 372.2 (Na 이산화물) |
meta-protease 전반 | 가역성 | 1~10mM | 0.5M 수용액, pH 8.0 |
| Elastinal | 512.6 | elastase형 serine protease | 가역성 | 10~100uM | 10mM 수용액 |
| Leupeptin | 426.6 | trypsin형 serine protease 일부의 cystein protease |
가역성 | 10~100uM | 10mM 수용액 (-20도씨에서 1개월간 안정) |
| Pepstatin | 685.9 | 일부의 asparagin산 (산성) | 가역성 | 1uM | 1mM methanol 용액 또는 DMSO 용액 protease (-20도씨에서 수개월간 안정) |
| 1,10-Phenanthroline | 198.2 | meta-protease 전반 | 가역성 | 1~10mM | 200mM methanol 용액 (차광보존, -20도씨에서 수개월간 안정) |
| PMSF | 174.2 | serine-protease 전반 | 불가역성 | 0.1~1mM | 200mM methanol 용액, 독성 (DFP보다 약함, -20도씨에서 수개월간 안정) |