Microbial growth
cytoplasmic membrane 은 세포를 완전히 감싸고 있는 얇은 막 구조 이다.
약 8nm 두께 밖에는 안 되지만 매우 중요한 구조로 세포의 외부와 내부를 구분해주는 역할을 한다.
만약에 이 벽이 깨진다면 세포의 구성성분들이 외부로 나와 세포가 파괴되고 결국에는 세포가 죽고 만다.
cytoplasmic membrane은 또한 세포 안에서 특정한 물질대사를 하고 필요 없는 물질은 방출하는 highly selective barrier 이다.
생물학적의 일반적의 벽(membrane)의 구조는 phospholipid bilayer(인지질 이중충)이다.
phospholipid 는 각각 소수성(hydrophobic, fatty acid)과 친수성(hydrophilic, glycerol) 을 반반씩 포함하고 있다.
인을 포함하고 있는 groups 이거나 fatty acids 가 glycerol backbone 에 붙어 그 결과 다양한 화학적 구조를 형성 할 수 있다.
이것들은 이중구조를 형성 하려고 하는 경향이 있다.
fatty acids는 hydrophobic environment(소수성 환경)에 향하고 있고
hydrophilic(친수성)한 부분은 수용성한 외부 환경에 노출되어 있다.
벽에 있는 층의 특징은 아마도 수용성한 환경 안에서 lipid분자가 가장 안정된 상태로 정렬되어 있는 것이 대표적일 것이다.
cytoplasmic membrane은 전자 현미경으로 관찰 할 수 있는데 검은색 지역에 의해 두가지 색으로 구분되어 나타난다.
phospholipid 층과 cytopalsmic membrane 안에 깊숙이 있는 proteins 을 구성하고 있는 것을 unit membrane 이라고 한다.
일반적으로 cell membrane의 주요 proteins는 세포의 바깥쪽과 안쪽에 서로 친수성한 표면이 노출되어 있고
또 벽과 벽 사이에 매달려 있는 이 단백질은 외부표면에 매우 hydrophobic(친수성)을 가지고 있다.
cytoplasmic membrane의 전반적인 구조는 친수성한 상호작용과 수소결합에 의해 안정되고 있다.
그리고 Mg²⁺과 Ca²⁺는 phospholipids의 negative charge(음전하)와 이온성 결합에 의해 membrane을 더 안정하게 도와준다.
cytoplasmic membrane의 바깥표면은 외부환경과 측면 해 있다.
그리고 특정한 bacteria 안에서는 여러 가지 단백질이 붙어 있는데 그 이유는 단백질이 물질을 잡거나 거대분자를 만들어
cell 안으로 수송시키기 위해서 이다.
cytoplasmic membrane 안쪽에는 세포질과 맡다있고
energy-yielding reaction(에너지를 사용하지 않고 에너지를 얻는 것) 과 다른 중요한 세포 적 기능을 하는
proteins 과 함께 상호작용을 한다.
약간의 periplasm과 약간의 cytoplasmic proteins와 같은 protein은
매우 단단히 막 표면과 결합되어 있고 막에 붙어 있는 proteins 과 같은 기능을 한다.
비록 그것들이 필수적인 막 단백질은 아니지만 여러 가지 cellular process 안에서
필수적인 단백질과 함께 직접적으로 항상 상호작용을 한다.
지방단백질(lipoprotein)과 단백질의 아미노 끝에 지질 꼬리 (lipid tail)를
포함하고 있는 것을 peripheral membrane proteins라 한다.
비록 도표를 보았을 때 단단한 무엇인가 보여도 cytoplasmic membrane은 매우 유동적이다.
phospholipid 와 단백질 분자는 막 표면에서의 움직임이 자유스러운 특징을 가지고 있다.
membrand의 접착성의 측정은 membrane이 가지고 있는 가벼운 등급의 oil(접착성이 적은 기름)에 근접한 접착성을 포함한다.
그러므로 membrane은 움직이기 쉬운 특별한 짧은 길이의 단백질, phospholipid bilayer로 구성된 유동적인 mosics라고 생각할 수 있다.
eukaryotic cell과 prokaryotic cell의 가장 큰 차이점 중 하나는 membrane의 화학적 구성 성분의 차이이다.
sterols는 모든 prokaryotic cell의 membranes에서는 볼 수 없다.
eukaryotic membrane의 total lipids 의 5%~25%를 sterols로 만들 수 있다.
sterolssms 단단한 2차구조인 반면에 fatty acids는 구부러지기 쉬운 구조이다.
sterols 와 membrane의 결합은 세포의 구조를 더 안정적으로 해주고 덜 유연하게 만들어 준다.
sterols와 비슷한 분자가 있는데 이것을 hopanoids 라 부른다.
이 hopanoids는 많은 Bacteria의 membrane에 존재 한다.
그리고 eukayotic cell 안에 sterols 와 유사한 기능을 한다.
하나의 구별되는 hopanoid 는 C30 hopanoid diplotene이다.
이 구조는 Archaea에서는 찾을 수 없는 특이한 구조이다.
Archaea 안의 lipids는 화학적으로 독특하다.
Bacteria 와 Eukarya 안의 lipids는 glycerol molecule의 fatty acids인 ester linkages bond 이다.
하지만 Archaea의 lipids는 glycerol과 hydrophobic side chains 사이의 ether likage이다.
게다가 Archaea의 lipids는 fatty acids 가 부족한 대신에 5탄당 탄화수소(five-caebon hydrocarbon) isoprene의
unit들이 반복되어 있는 side chains을 가지고 있다.
그러나 Archaea의 전반적 구조는 안과 외부가 친수성인 표면과 소수성인 내부를 형성하고 있는
lipid membranes로 구성 되어 있다.
Glycerol diethers와 glycerol tetraethers는 Archaea안에 존재하고 있는 주요 lipids의 구성성분이다.
각각의 glycerol molecule로부터 온 tetraether molecules인 phytanyl(isoprenes 4개로 구성)의
side chains이 서로 공유결합(covalent bond)을 하고 있다.
membrane structure 내에서는 lipid bilayer대신에 lipid monolayer를 더 많이 구성하고 있다.
lipid monolayers는 lipid bilayers에 비해서 더 견고하기 때문에 이 membrane structure가
hyperthermophilic Archaea(매우 높은 온도에서 자랄 수 있는 prokaryotes) 의 membrane structure로
구성된다는 것은 그다지 놀라운 일이 아니다.
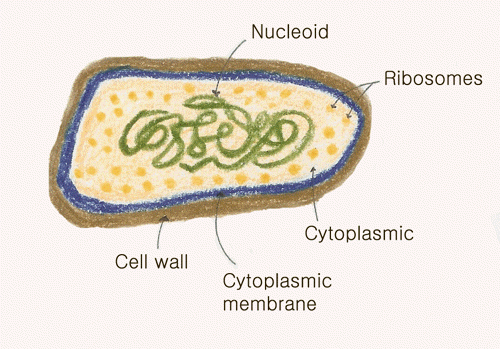
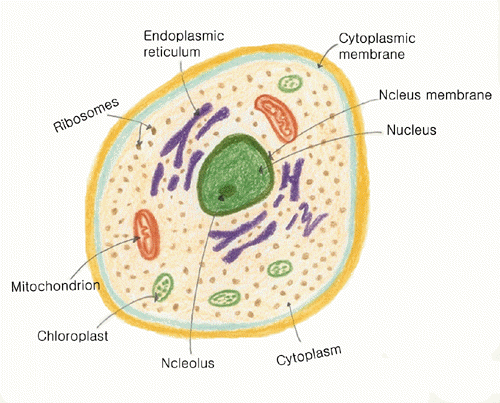
생물체는 구성세포의 구조 및 복합성 등에 의해 크게 prokaryotes와 eukaryotes의 두가지로 나눌 수 있다.
진핵생물은 구성세포가 고도의 분획화된 막 결합- 세포기관들을 가지며,
특히 유전물질이 막으로 구분되는 핵(nucleus)을 갖는다는 것이 현저한 특징이다.
반면에 원핵생물은 Bacteria처럼 원핵생물계에 속하는 단일세포 생물로서,
원핵생물의 DNA는 핵막으로 둘러 싸여 있지 않으면, 다른 막결합-세포기관 또한 없다.
Bacteria를 비롯한 원핵세포는 대체로 진핵세포보다 훨씬 작아서, 평균 진핵세포 지름의 약 10분의 1에 불과하다.
간단히 표로 두 세포의 차이를 알아보겠습니다.
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
진핵세포에는 막으로 둘러싸인 핵이 존재하는 반면 원핵세포에는 핵구조가 없다. 진정세균과 고세균은 원핵생물이고 그 밖의 모든 개체, 조류, 진균류, 고등 동식물은 모두 진핵생물이다. 원핵생물은 대개 진핵세포보다 작고 진핵세포의 미토콘드리아나 엽록체 크기 정도인 경우가 많다. ☞진핵세포와 원핵세포의 특징을 비교하여 보면
비교하여 보면 위의 표와 같다. 진핵세포에는 핵과 막구조로 이루어진 세포소기관이 있으나 원핵세포에는 존재하지 않는다. 원핵생물은 기능적인 면에서도 단순하다. 원핵생물에서는 유사분열이나 감수분열의 과정이 일어나지 않으며 유전자의 구조도 훨씬 단순하다. 식세포작용, 음세포작용, 세포내 소화, 원형질 유동, 아메바 운동 등의 복잡한 과정 역시 진핵세포에서만 나타난다. 원핵세포와 진핵세포는 여러가지 구조와 기능적 측면에서 다른 점이 있지만 생화학적 수준에서는 놀랄 만큼 비슷하다. 두 종류의 세포 모두 화학적 조성은 매우 유사하다. 몇가지 예외를 제외하면 유전암호도 동일하며 DNA에 있는 유전정보가 발현되는 과정 역시 근본적으로 동일하다. 대사의 원리와 생명현상을 나타내는 데 열쇠가 되는 중요한 대사과정 또한 같다. 그러므로 표면적으로는 원핵세포와 진핵세포가 구조적, 기능적 차이를 보이지만 분자수준에서는 근본적으로 동일한 원리를 바탕으로 한 생명현상을 나타낸다. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
세포는 생명체의 기본단위이다.
이러한 사실은 19세기 전반(1838~1839), 독일의 식물학자 M. Schleiden 과
동물학자 T. Schwann 이 자신들의 관찰을 근거로 하여 식물과 동물체를 이루는 기본단위가 세포임을 주장하면서 밝혀졌다.
근래에 이르러서는 전자 현미경과 동력활달법(freeze etching)등의 기술이 발달하여
세포 내부의 복잡한 구조까지도 상세히 밝히게 되었다. 세포의 미세구조물들을 각각 특유의 기능을 가지면서
세포라는 단위를 이루고 있으며, 여러 가지 물리 · 화학적 분석방법에 의하여
그 구성분자의 특성이나 기능도 밝혀지고 있다. 또한 부분적으로는 이들 미세 구조물의 해체나 재구성도 가능하게 되었다.
동의어
정의
• 2. 청각이나 후각을 지지하는 등의 일반 기능을 가진 중추신경계 신경세포의 집단.
• 4. 유기 화합물 또는 화합물 덩어리 내 중심 원소.
특수한 다핵세포(multinuclear dell)나 무핵세포(non-nuclear cell)를 제외하고는,
일반적으로 1개의 세포에는 1개의 핵이 존재한다.
핵의 크기는 지름이 5~8μm 정도이며,
전자 현미경으로 관찰하면 염색질(chromatin),인(nucleolus), 핵질(karyoplasm), 핵막(nuclear membrane)등을 확인할 수 있다.
핵과 세포질 사이에는 8nm의 두께를 가진 이중층막으로 된 핵막이 있으며,
핵막 중 세포질 쪽으로 향한 막에는 부분적으로 소포체(endoplasmic reticulum)가 연결되어 있으며,
리보솜(ribosome)이 부착되어 있는 핵막에는 지름이 70~150nm 정도인 핵공(nuclear pore)이 여러 개 있으며,
RNA를 포함한 커다란 과립성 물질이 이 핵공을 통하여 핵으로부터 세포질 속으로 이동하여 나오게 된다.
분열기에는 일시적으로 핵막이 소실되지만, 분열의 종기가 되면 소포체의 작은 조각들로부터 다시 핵막이 형성된다.
인(nucleolus)은 핵 속에 1개 또는 여러 개가 존재하는데, 이들의 지름은 2~5μm이며,
가느다란 섬유와 전자밀도가 다소 낮은 과립으로 구성되어 잇다. 짚신벌레의 소핵(micronucleus)이나 동물의 정자핵에는 인이 없다.
인에는 염기성 단백질과 RNA 중합효소(polymerase), DNA 합성효소 등의 효소 이외에 10% 정도의 RNA가 존재한다.
세포질의 rRNA(ribosomal RNA)는 인 형성 염색질의 DNA 염기배열(DNA base sequence)에
따라 우선 큰 RNA 복합체(rRNA 전구체)로서 합성된 후, 절단에 의해 28s와 16s 인 RNA로 되어 세포질 속으로 나온다.
염색질(chromatin)은 전자밀도가 높은 과립의 집합체로서 핵막의 안쪽과 인 주위에 있으며,
DNA와 염기성 핵단백질, 즉 히스톤(histone) 복합체를 주성분으로 하여
소량의 비히스톤(nonhistone) 단백질과 RNA가 첨가되어 구성된다.
DNA의 인산과 히스톤은 정전기적(靜電氣的)으로 결합하여 DNA분자가 안정성과 유연한 구조를 유지하도록 한다.
RNA 합성에 관여하고 있는 DNA는 풀어진 상태로 핵질의 투명한 부분에 존재한다.
간세포, 신경세포등 대사가 활발한 세포의 핵은 밝고 염색질이 적다.
세포 안에 유전자의 형태로 유전정보를 가지고 있는 실 모양의 현미경적 구조.
염색체의 구조와 위치는 원핵세포와 진핵세포를 나누는 기준이 된다.
세균이나 남조류와 같이 원핵세포로 구성된 생물에서는
염색체가 전부 디옥시리보핵산(deoxyribonucleic acid/DNA)으로 구성되어 있다.
원핵세포의 단일염색체는 핵막으로 둘러싸여 있지 않지만,
진핵세포의 염색체는 막으로 둘러싸인 핵 안에 존재한다.
진핵세포의 염색체는 주위에 단백질이 붙어 있는 DNA로 구성되어 있다.
원핵세포와 진핵세포 모두, 염색체상에 존재하는 DNA의 염기배열에 의해 유전정보가 결정된다.
모든 종(種)은 고유한 염색체수를 가지고 있다. 무성생식을 하는 종에서의 염색체수는 그 생물을 구성하는 모든 세포들에 있어 동일하지만, 유성생식을 하는 생물에서는, 몸을 구성하는 체세포의 염색체수는 이배체(2n)이고, 성세포 또는 배우자의 염색체수는 반수체(n)이다. 반수체의 염색체는 감수분열 과정에서 생성된다. 수정과정에서 2개의 배우자가 결합해 이배체 염색체를 갖는 단세포인 접합자를 이룬다. 체세포는 유사분열에 의해 분열한다. 세포분열과 세포분열 사이에 유전물질인 염색질은 염색사라고 하는 필라멘트의 망구조로 핵 전체에 퍼져 있다. 이러한 긴 필라멘트는 풀려진 염색체로부터 형성되는데 이 상태에서 표면적이 넓어짐으로써 DNA 합성을 촉진하는 것으로 보인다. 이 시기에 DNA의 양이 배(倍)로 복제된다.
세포분열이 시작될 때 염색사는 응축되어 꼬이고 단백질 층에 둘러싸여 아주 작은 염색체를 형성한다. 실제로 각 염색체는 동원체에 의해 서로 결합되어 있는 1쌍의 염색분체로 이루어져 있다. 동원체는 염색분체를 세포의 반대편 끝으로 끌어당기는 구조물인 방추사와 결합하는 부분이다. 세포분열의 중간단계에서 중심체가 복제되고 염색분체쌍이 나뉘게 되는데 각 염색분체는 이 시기에 독립된 염색체가 된다. 세포가 분열하면 2개의 딸세포는 하나의 완전한 염색체 세트(이배체)를 가지게 된다. 이어 새로 형성된 딸세포의 염색체가 풀리게 되고 필라멘트의 망구조가 다시 형성된다. 성(性)이 분리되어 있는 생물체는 기본적으로 성염색체와 상염색체(常染色體)의 2가지 형태 염색체가 있다.
염색체는 염색사로 구성되어 있으며 이것을 염색을 해 보면 진하게 염색되는 부분이 있는데 이 부분을 이질 염색질 (heterochromatin)이라 부르고 염색이 잘 되지 않는 부분을 진정 염색질(euchromatin)이라 부른다. 이질 염색질은 상당히 많이 꼬여 있기때문에 전사나 다른 유전 활동이 덜 함에 비하여 진정 염색질은 덜 꼬여 있기 때문에 전사나 다른 유전활동이 활발하게 일어 날 수 있다.
염색체의 구조는 동원체(centromere)을 중심으로 가장 끝부분에 존재하는 단부동원체형 (telocentric), 끝부분과 동원체 부분까지를 말단 동원체형(acrocentric),동원체 부분을 중부 동원체형(metacentric)으로 나눌 수 있다. 특히 가장 끝부분에 존재하는 부분을 말단소립(telomere)이라 불린다. DNA가 복제가 되고 분열이 될때에 사용되는 많은 기구들은 염색체상에 결합을 한 후에 바로 유전자를 복제 하는 것이 아니라 일정한 부분을 이동을 한후에 유전자를 복사하게 된다. 즉 이 기구들이 말단소립이라는 아무 의미없는 연속적인 염기서열에 결합을 하여 일정부분을 이동한 후에 유전자들을 복제를 시작하게 된다. 만약 이 말단소립부분이 없다면 염색체 끝부분에 존재하는 유전자에 복제기구들이 결합을 하게 되어서 결국 이 부분에 해당하는 부분은 복제를 할 수 없게 되는데 이런 오류를 막기 위하여 존재한다고 전해지며 현재 밝혀진 바로는 노화에도 이 말단소립이 관여 한다고 알려져 있다.
진핵생물 염색체의 내부는 피막에 싸여 있고, 핵단백질이 겔상태로 존재하는 기질(matrix) 속에는 염색사(chromonema)가 있어서 염색체의 주체가 된다. 그리고 이 염색사에는 주로 DNA가 들어 있다. 염색사는 군데군데 심하게 꼬여서 염색소립(chromemere)을 이루며, DNA 이외에 약간의 RNA가 들어 있는 경우도 알려졌다.
세포분열 간기의 핵에서 염색체는 단백질, DNA 그리고 소량의 RNA로 구성된 염색질의 형태로 존재한다. 핵단백질은 알칼리성 단백질인 히스톤과 비히스톤단백질(이질적 산성 단백질)로 구성 되어 있다. 히스톤은 염색질의 구조형성에 주요 역할을 하는데 고등생물의 히스톤은 5종유(H1, H2A, H2B, H3, H4)로 되어 있다.
히스톤 H1, H2A, H2B, H3, H4는 모든 생물의 세포에서 거의 같은 양을 가지고 있으며, 다양하게 분화된 종 사이에서도 일정하다. 그 점으로 보아 히스톤은 염색질의 구조에 중요하며 유전자 기능에는 비특이적으로 작용한다. 는 의미가 있다.
한편, 비히스톤단백질은 수많은 이질 단백질로 구성되어 있으며, 같은 종에 있어서도 세포 모양에 따라서 그 구성이 다양하다. 따라서 이것은 특이한 유전자 발현의 조절에 관여 할 것으로 믿어진다.
뉴클레오솜은 전자현미경으로 관찰하면 염주를 줄에 꿴 모양으로 보인다. 뉴클레오솜은 DNA를 규칙적으로 감아서 package 한다. 뉴클레오솜의 구조는 8~114 뉴클레오티드 쌍으로 연결된 연결DNA와 8합체 히스톤 (H1, H2A, H2B, H3, H4 가 각각 2분자로 구성)과 이를 1과 3/4쯤 둘러감은 146염기쌍으로 구성되어 있다.
• 정의
-사립체, 미토콘드리아
-박테리아, 바이러스, 성숙적혈구를 제외한 모든 살아있는 세포안의 과립형 소기관
•
내용
-세포내 대사와 호흡기능을 한다.
-세포에 필요한 에너지를 ATP형태로 생성한다.
거의 모든 진핵세포에서 발견되는 미토콘드리아(mitochondria)는 종종 세포의 발전소로 일컬어진다. TCA회로의 활성과 전자전달과 산화적 인산화 과정에 의한 ATP합성이 미토콘드리아에서 일어난다. 투과전자현미경으로 보면 미토콘드리아는 대개 폭이 0.3~1.0 μm, 길이가 5~10μm인 원통형 구조이다. (이는 세균세포의 크기와 같다). 세포에는 보통 1,000개 이상의 미토콘드리아가 있지만 효모의 일부, 단세포 조류, 트리파나좀(trypanasome) 원생동물 등 몇 종에서는 하나의 거대한 관상 미토콘드리온이 세포질 전체에 퍼져있다.
미토콘드리아는 이중막으로 둘러싸여 있으면 미토콘드리아의 외막과 내막 사이에는 6~8nm 정도의 공간이 있다. 내막은 주름이 많이 잡힌 크르스테(cristae, 단수는 crista)구조를 이루고 있어 막의 표면적이 매우 넓다. 크리스테 구조는 생물종마다 다르다. 진균류에서는 평판모양의 크리스테를 이루는 반면 유클레나와 같은 편모충류에서는 원반형을 이룬다. 관상 크리스테 또한 여러 종의 진핵세포에서 발견된다. 그러나 아메바에서는 소포형의 크리스테 구조를 한 미토콘드리아가 존재한다. 내막은 미토콘드리아의 기질을 둘러싸고 있다. 미토콘드리아 기질은 매우 조밀하며 리보좀과 DNA가 있고 때로는 커다란 인산칼슘 입자가 존재하기도 한다. 미토콘드리아에 있는 리보좀은 세포질에 있는 리보좀보다 작고 크기와 소단위의 구성성분 등 여러 면에서 세균의 것과 유사하다. 미토콘드리아 DNA는 세균의 DNA와 마찬가지로 환형 구조이다.
미토콘드리아는 가 구획마다 존재하는 화학성분이나 효소의 종류가 다르다. 외막과 내막을 구성하는 지질의 조유도 다르다. 전자전달 및 산화적 인산화 과정에 관여하는 효소나 전자 수용체는 미토콘드리아의 내막에 존재한다. TCA 회로와 지방산의 β-산화과정을 수행하는 효소는 미토콘드리아의 기질에 위치한다.
미토콘드리아의 내막에는 대략8.5nm인 작은 구형 입자가 안쪽 표면에 붙어있다.
이것이 F₁입자이며 세포내 호흡과정에서 ATP를 합성한다.
미토콘드리아에 있는 DNA와 리보좀은 미토콘드리아 DNA에 돌연변이가 일어나서 나타나는 질병도 있다. 그러나 대부분의 미토콘드리아 단백질 유전자는 핵 DNA에 존재한다. 미토콘드리아는 이분법에 의해 분열한다. 엽록체 역시 미토콘드리아와 마찬가지로 부분적인 독립성을 보이며 이분법으로 분열한다. 이들 세포소기관은 여러 측면에서 세균과 닮아 세균과
커다란 세포사이의 공생관계에서 이러한 세포소기관이 형성되었다고 생각되고 있다.
☞미토콘드리아의 효소 분포
|
외막 |
모노아민 산화효소, 시트크롬 b5 |
|
막강공간 |
아테닐산키나아제 |
|
내막 |
숙신산 탈수소효소. 시토크롬 산화효소, F₁- ATPase |
|
기질 |
TCA 회로 효소계 지방산 β-산화효소계 |
녹색식물이나 조류(藻類)에는 성장과정이나 생리조건에 따라 세포내에 다양한 종류의 색소체(plastid)가 존재한다. 즉 엽록체나 엽록소(chlorophyll)를 포함하지 않는 백색체(leucoplast), 저장녹말을 가지고 있는 아밀로플라스트(amyloplast), 노란색을 띠는 유색체(chromoplast)등의 여러 색소체가 존재한다. 이중에서 엽록체는 광합성의 여러 반응이 진행될 수 있도록 막상구조를 분화되어 있다.
일반 식물에서의 엽록체는 지름이 2~3μm, 길이가 5μm정도인 타원형으로 되어 있으니, 하등식물이나 조류 등에서는 크기와 몽양이 여러 가지로 변형된 것들도 있다. 세포 안 에 함유되어 있는 개수는 일정하지 않으나, 엽육(mesophyll)세포에는 수십 개에서 수백 개의 엽록체가 있다. 엽록체는 각각 2중의 막으로 싸여 있으며, 그 내부는 막구조인 틸라코이드막(thylakoid membrane)과 가용성 물질을 함유하는 스트로마(stroma)로 이루어져 있다.
틸라코이드막에는 부분적으로, 지름이 약 0.5μm 정도인 원판이 여러 개 쌓여 겹쳐진 듯한 모양의 그라나(grana)가 있으며, 광학현미경으로 관찰하면 짙은 녹색의 입상구조로 되어 있음을 알 수 있다. 엽록소를 비롯한 각종 광합성색소와 광합성의 전자전달성분, 에너지 전환반응을 하는 인산화의 공역인자(coupling factor)등은 틸라코이드막에 존재한다. 따라서 빛에너지에 의한 여기(exction)로부터 전자전달을 거쳐 ATP 합성에 이르는 반응이 틸라코이드막 안팎에서 진행된다.
틸라코이드막에는 다른 세포 내막에서와 마찬가지로 단백질과 지질이 거의 같은 비율로 존재하지만 인지질이 적고 당지질이 많은 것이 특징이다.
스트로마에는 광합성과정인 캘빈회로의 효소를 비롯하여 각종 효소와 단백질, 엽록체 특유의 RNA와 DNA등이 함유되어 있으며, 엽록체 무게의 60% 이상을 차지하고 있다. 광합성 때에 전자전달 역할을 하는 플라스토퀴논(plastoquinone)을 함유하고 있는 프라스토과립은 틸라코이드막과 접하면서 스트로마 속에 존재하고 있음을 전자현미경으로 관찰할 수 있다.
세포질에는 세포골격 외에도 대략 지름이 40~70nm 의 막성소관이 망상체계를 이루고 있다. 이러한 소관은 납작한 주머니 형태의 시스터나(cisternae)구조를 이루며 지속적으로 새로운 부분으로 나뉘고 또 서로 융합된다. 이와 같은 막성소관과 주머니가 이루는 그물조직을 소포체(endoplasmic reticulum ER)라 부른다.
소포체의 특징은 세포의 기능과 생리적 상태에 따라 조금씩 다르다. 분비 단백질을 많이 합성하는 세포에서는 소포체 바깥쪽에 리보좀이 많이 부착되어 있다. 이를 조면 소포체(rough 또는 granular endoplasmic reticulum, RER 또는 GER)라 한다. 지방질을 다량 합성하는 세포에서는 리보좀이 부착되지 않는 활면 소포체(smooth 또는 agranular ER, SER 또는 AER)가 대부분을 차지한다.
소포체는 여러 가지 중요한 기능을 담당한다. 단백질, 지질 등 여러 종류의 물질을 세포 전체에 구석구석 운반한다. 지질과 단백질은 소포체에 연관된 효소나 리보좀에서 합성된다. 폴리펩티드 사슬을 조면소포체에 부착된 리보좀에서 합성되어 조면소포체의 막을 통과하여 소포체 내강으로 들어가 다른 곳으로 운반된다. 소포체는 또한 세포막 합성이 일어나는 주된 장소이기도 하다.
새로운 소포체 단백질과 지질을 합성한다 고 해각하고 있다. ‘오래된’ 조면소포체에서 리보좀이 떨어져 나가고 변형되어 활면소포체가 된다는 것이다. 그러나 이러한 가설을 모두가 지지하는 것은 아니다. 다른 방법으로 소포체가 만들어지는 것 역시 가능하다.
골지체(golgi apparatus)는 납작한 주머니모양의 시스터나(cisternae)가 서로 겹쳐져 형성된 세포소기관이다. 골지체에도 활면소포체와 마찬가지로 리보좀이 결합되어 있지 않다. 더 많은 것도 있지만 보통 4~8개 정도의 납작한 막성주머니가 겹쳐져 골지체를 형성한다. 주머니 하나의 두께는 15~20nm 정도이며 각각 20~30nm 정도씩 떨어져 있다.
시스터나(cisternae)의 양끝 쪽에는 지름이 20~100μm 정도의 소관과 소낭이 복잡하게 얽혀 있다. 막주머니의 양쪽 면은 서로 아주 다르며 이에 따라 시스터나(cisternae)의 층은 극성을 나타낸다. 소포체와 연관되어 있는 생성면(cis face 또는 maturing face)과 막의 두께, 효소의 구성, 소낭 형성의 정도가 서로 다르다. 세포 안쪽에 있는 주머니에서 소낭이 떨어져 나온 다음 그 다음 층의 막과 융합되는 과정을 통해 골지체의 안쪽에서 바깥쪽 빵향으로 물질이 이동하는 것이라 생각 된다.
골지체는 거의 모든 진핵세포에 존재하나, 진균류나 섬모충류 중에는 명확한 구조를 이루는 골지체가 없는 것도 많다. 어떤 세포에는 골지체가 하나만 존재하기도 하지만 대부분의 경우에는 20개 정도 또는 그 이상의 골지체를 지닌다. 여러 개의 골지체가 한 곳에 모여 있는 것을 딕티오좀(dictyosome)이라고 부르며 이렇게 한 부분에 모여 있지 않고 여기저기 떨어져 있는 겨우도 있다.
골지체는 세포내에서 생성된 물질을 포장하여 분비될 수 있는 형태로 변형시키는 것이 일반적인 기능이나 정확한 기능은 세포나 개체에 따라 다르다. 편모 조류와 원생동물 일부의 표면에 있는 비늘과 같은 구조는 골지체에서 형성되어 소낭을 이용해 세포표면으로 이동한다.골지체는 세포막의 합성과 세포 산물의 수송에도 관계한다. 골지체가 균사(hapha)의 성분을 균가 끝 부분의 세포벽에 붙여서 진균세포의 균사가 형성된다.
이러한 과정을 통해서 물질은 소포체로부터 골지체로 이동된다. 대부분 소포체에서 떨어져 나온 골지체로 이동된다. 대부분 소포체에서 떨어져 나온 소낭은 골지체로 이동하여 생성면(cis face)쪽에 있는 막층과 융합된다. 따라서 골지체는 소포체와 구조와 기능적인 면에서 매우 깊은 관련이 있다. 소포체에서 골지체로 들어가는 단백질 대부분은 당단백질로 짧은 탄수화물 사슬이 붙어 있다. 골지체에서는 다른 곳으로 이동하는 단백질에 특정한 작용기를 부착하여 변형시킨 다음 적절한 장소로 보낸다. 예를 들어 리소좀 단백질은 탄수화물 사슬의 만노wm 잔기에 인산기를 부착시킨다.
정의
• 세포 내 소화 과정에 작용하는 가수분해효소를 포함하는 세포질의 막성 소기관.
리소좀은 식세포작용이 알려지게 된 1800년대 후반부터 그 존재가 인식되었으나 확실한 증거는 1950년 A. Novikoff 와 C. De Duve에 의해 밝혀진 세포기관의 일종이다. 리소좀은 각종 세포의 세포질 내에 존재하며, 한 층의 인지질 이중막으로 둘러싸인, 지름이 25nm이상인 둥근 모양이 구조물로서, 골지체로부터 만들어져 소포의 형태로 분리되어 나온다. 리소좀은 동물세포내의 소화기관으로, 약 50종류의 가수분해 효소가 함유되어 있으므로 단백질, 다당류, 지질, 핵산 등 거의 모든 형태의 생체 거대분자를 아미노산, 단당류, 뉴클레오티드 등으로 분해한다.
리소좀은 다양한 작용을 한다. 즉 외부로부터 식세포작용이나 음세포작용으로 받아들인 이물질의 제거, 과잉 생산된 분비과립 혹은 불필요한 세포내 기관의 제거 같은 기능을 갖는다. 리소좀은 이물질, 세포기관 혹은 세포와 막 융합을 통하여 잔여소체를 형성한 후 세포 밖으로 방출되거나 세포내에 남아 있기도 한다.
J. Rhodin(1954)은 쥐의 신세뇨관 세포에서 새로운 소기관을 발견했고, 나중에 간에서도 같은 구조의 소체를 발견했다. 이 세포기관은 지름이 1μm 정도 되는 막에 싸인 과립인데, 카탈라아제(catalase)나 과산화효소(peroxidase)의 활성을 가지고 있기 때문에 퍼옥시솜(peroxisome) 이라 한다.
퍼옥시솜은 미토콘드리아 수의 약 1/4 정도이며, 막은 한 겹으로 되어 있어서 투과성이 높고 그 모양에 따라 미소체(microbody)라고 할 때도 있다. 이 과립에서는 아미노산, 알코올 등이 산화되어 관산화수소가 생성되는데 이를 카탈라아제가 분해시킨다. 식물에서는 지방산의 대사를 수행하는 글리오시솜(glyoxysome)이 퍼옥시솜과 같은 것으로 보고 있다.
그리고 원생동물, 조류, 곰팡이 등에서도 발견된다
• 정의
-세포골격
-미세섬유와 각질, 장원섬유를 포함하는 세포질의 요소
동물의 조직에 따른 세포 모양의 차이와 세포의 이동은 대체로 진핵세포에 존재하는 세포골격(cytoskeleton)이라는 단백질 섬유들에 의해 조절된다. 이 세포골격은 실제로 매우 역학적이면 일정한 변화를 수반하고, 단순한 골격 형성만이 아니고 분비, 운동, 정보전달 등 세포의 종류에 따라서 여러 가지 기능이 추정된다. 세포골격은 3가지 종류의 필라멘트구조로 된 단백질 즉 미세소관(microtubule), 미세 필라멘트(microfilament), 중간형 필라멘트(itermediate filament)로 구성되어 있다. 미세소관은 튜불린 단백질(tubulin) 서브유니트로 구성된 단단하고 긴 관의 형태이며, 미세 필라멘트는 액틴(actin)단백질이 나선상으로 중합되어 구성된 견고하고 얇은 구조로 되어 있다. 이들 단백질들은 구슬 모양의 구형 단백질 단위분자들 로 구성되어 있으므로 빠르게 조립 또는 해체될 수 있다.
세포의 골격을 형성하는 단백질 필라멘트는 크기에 따라 지름이 7μm인 액틴 필라멘트(actin filament)와 25nm인 미세소관의 2가지 형태가 있다. 중간형 필라멘트는 몇 종류의 섬유상 단백질 서브유니트로 형성되므로 위의 두 단백질 필라멘트보다 더 안정된 형태이다.
미세소관은 원생동물인 태충(actinophrys)등에서 볼 수 있는 침상의 축족, 일반세포의 핵분열시 나타나는 방추사, 정자와 같은 각종 세포의 편모(flagellum)등 세포운동이 일어나는 곳에 널리 존재한다. 전자현미경을 이용하여 미세소관의 횡단면을 관찰하면 5nm 지름의 단백질 분자와 튜불린(tubulin)이 연결된 섬유 13개가 미세소관의 벽을 이루고 있음을 볼 수 있다.
진핵생물의 편모나 섬모(cilium)에는 2개의 미세소관 또는 중심미세소관(central microtubule)을 둘러싸고 그 주위에 9쌍의 더블릿 미세소관(doublet microtubule)이 배열되어 축사(axoneme)를 이루고 있다.
이 더블릿 미세소관 한쪽에는 단백질로 구성된 디네인 팔(dynein arm)이 결합하고 있으며, ATP 분해에 의한 에너지에 의하여 이웃한 더블릿 미세소관과 서로 엇갈려 미끄러져서 운동을 일으키게 된다.
미세 필라멘트는 미오신 단백질과 함께 근수축 운동을 담당하거나 세포막 아래층에 배열되어 세포형태의 유지 및 세포질분열시 세포질 만입 등에 관여한다. 중간형 필라멘트는 핵막, 골지체 등 세포기관의 구조적인 지지기능을 담당한다.
중심체(centrosome)는 세포분열의 중심적 역할을 수행하는 세포기관이다. 동·식물의 세포질내에 있고, 그 중심부에 중심립(centriole)이 있다. 휴지핵 속에는 1개의 중심체가 있지만 핵분열이 시작되면 2개로 분열하여 각각 양극으로 이동한다.
중심체의 주위에는 성상체가 발달하고 두 중심체 사이에 방추체(spindle)가 형성되며 염색체는 방추사(spindle fiber)와 결합하여 양극에 있는 중심체 쪽으로 이동한다.
액포는 공포라고도 한다. 이 주머니구조에는 투명한 수용액이 들어 있다. 정상적인 동물세포에서는 보기 어려우나 식물에서는 노화에 따라 대형화한다. 늙은 세포에서는 액포가 세포 중앙의 대부분을 차지하여 세포질과 핵질이 주변으로 밀려나 있는 모양을 보인다. 액포를 둘러 싼 막을 액포막(tonoplast)이라 하는데 생체막과 공동적으로 3층구조를 하고 있으나 특이적 투과능을 나타내고 있다. 세포 외액을 고장액으로 했을 때 세포막은 반투성을 상실하여 세포내가 고장화되어도, 액포막은 반투성을 유지하여 수축이 가능하다. 액포내의 액체를 세포액(cell sap)이라 하며, 당, 유기산 외에도 색소(안토시안), 알칼로이드(담배의 니코친)등의 특유한 성분을 함유한다. 액포는 그 흡수력에 의해서 팽압을 이루고 세포벽의 긴장 상태를 나타낸다. 액포가 생기는 1가지 원인은 세포의 노화에 의한 노폐물 축적에 있다고 생각된다.
-Membrane transport systems
과생산된 영양성분의 이동과 방출은 세포에서 일어나는 일 중 중요한 역할을한다. 이동을 위한 다른 mechanisms는 prokaryotes에서 매우 혁명적이며, 이 각각은 단일의 특색을 가지게 된다. Membrane transport proteins의 기능과 구조를 살펴보면, prokaryotes에서는 기질을 이동시키기 위한 세 가지 system이 존재한다.
그 세 가지를 각각 simple transport, group translocation, 그리고 ABC system이라고 한다. 단순한 transporters는 세포막에 박힌 단백질만을 필요로 한다. Group translocation은 transport가 일어나는 사건에서 protein이 연속으로 존재해야 한다. ABC system은 substrate-binding protein, membrane transporter, 그리고 ATP-hydrolyzing protein을 필요로 한다.
Transport systems의 모든 것은 proton mortive force라는 에너지, ATP에서 온 에너지, 또는 에너지를 많이 가지고 있는 다른 compound에서 에너지를 얻는다.
사실상 모든 박테리아의 transport systems의 membrane에 박혀있는 protein에서는 그들의 1차, 2차 구조에서 significant homologies를 볼 수 있는데, 이는 그들의 일반적 evolutionary roots에 근거한다고 볼 수 있다. 구조적으로, 이 transproters의 형태는 12개의 α-helices로 구성되어 있는데 이것은 membrane에 박혀있는 형태로 존재하고 이동하는 기질이 channel을 통과할 수 있도록 형태가 구성되어 있어서 cell 밖의 기질을 cell 안으로 들어올 수 있도록 도와주는 역할을 한다.
활성을 띈 transport event는 기질이 protein에 binding 된 후 protein의 conformational change가 일어나면서 transport가 일어나고, 이 event는 기질이 cell 안으로 membrane을 가로질러서 들어올 수 있도록 도와주는 역할을 한다.
Transporters의 최소의 세 가지 classes는 각각 Uniporters, Symporters, Antiporters라고 명명한다.
Uniporters : 단일 물질이 혼자서 membrane에 박혀있는 protein을 가로질러서 cell 안으로 들어갈 수 있는 것을 말한다.
Symporters : 다른 기질과 필요한 기질이 서로 binding해서 같은 방향으로 membrane에 박힌 protein을 가로질러서 cell안으로 들어가는 것을 이야기한다.
Antiporters : 이들의 이름은 implies라고 하고, cell 바깥의 기질이 cell 안의 기질과 서로 다른 방향으로 protein을 가로질러서 cell안으로 들어가는 것을 이야기한다.
Lactose Uptake in Escherichia coli : The Lac permease
박테리아에 속하는 microorganisms 중 대표적인 Escherichia coli(E.coli)는 disaccharide sugar인 lactose를 이용해서 대사를 한다. Lactose는 Lac permease라고 불리는 symporter의 activity를 통해서 E.coli의 세포 안으로 들어가게 된다. Lac permease는 simple transporter이다. Lac permease의 activity는 uniporters 또는 antiporters와 같은 기능을 가진 것을 포함하는 다른 simple transporters와 함께 compare되어 있다.
Lac permease는 에너지를 필요로한다. 각각의 latose molecule은 cell 안의 수소의 co-transport에 의해서 느리게 감소되는 proton motive force에 의해서 에너지를 얻는다.
Lac permease의 activity의 결과 생긴 net charge는 cell을 위해서 사용될 수 있는 에너지의 yield를 이용해 대사할 수 있는 높은 농도의 Lactose를 축적하는 데 이용된다.
Group translocation : The phosphotransferase system
Transport 되는 기질의 transport mechanism인 group translocation은 membrane을 가로질러서 통과하는 동안 사용되는 화학적 과정이다.
Group translocation을 살펴보는 가장 좋은 방법은 E.coli 내부의 glucose, mannose, fructose 등의 sugars의 transport를 살펴보면 된다.
이 compounds는 phosphotransferase system에 의해서 phosphorylation되어 옮겨진다.
이 phosphotransferase system은 protein으로 구성되어 있는데, 이것은 5개의 protein을 필요로 한다.
Sugar가 옮겨지기 전에, phosphotransferase system의 protein은 membrane에 박혀있는 protein에 전달되기 전에 그들 스스로 증폭되어 phosphorylation과 dephosphorylation이 되는데, 이러한 일을 하는 효소를 Enzyme Ⅱc라고 하고, 이것은 phosphate group을 옮겨주고, actual transport event에 의해서 sugar에 phosphorylation을 한다.
한 작은 protein을 HPr이라고 하고, EnzymeⅠ이 phosphorylation에 관여하고, EnzymeⅡa는 cytoplasmic protein이다. 대조적으로 EnzymeⅡb는 내부 membrane 표면에 누워있고, EnzymeⅡc는 membrane에 박혀있는 단백질이다. HPr과 EnzymeⅠ은 특이한 Enzyme Ⅱ 가 각각의 독립적인 sugar를 transport하기 위해 존재하는 동안 다양한 sugars의 ,uptake에 관여하는 것과 phosphotransferase system의 특별하지 않은 components이다.
Phosphotransferase system으로부터 얻은 에너지는 phosphoenolpyruvate라는 에너지를 많이 가지고 있는 compound로부터 온다. 그러나, 하나의 에너지를 많이 가지고 있는 phosphate bond의 형태에서 온 에너지일지도 특색있는 이것은 glucose molecule을 옮기는 process에 포함되어있다.
Glucose에서 glucose-6-phosphate로 phosphorylation하는 것은 세포 내부의 대사 과정에서 첫 번째 step이다. 그러므로, phosphotransferase system은 중앙의 대사 과정에서 직접 들어가기 위한 glocose의 준비과정이라고 할 수 있다.
Periplasmic binding proteins and the ABC system
Periplasm은 다양한 protein으로 구성되어 있고, transport의 많은 기능을 가지고 있다. 이것을 periplasmic binding protein이라고 한다.
Transport system은 세 가지 components로 나뉘어 볼 수 있다.
① Periplasmic binding proteins
② Membrane spanning proteins
③ ATP-hydrolyzing proteins(kinase)
이 중 마지막 것은 에너지를 필요로 하는 것이다. 이러한 type 의 transporters는 ABC transport system이라고 불리어 졌는데, 그 이유는 ATP를 binding 하는 cascatte를 위해서 ABC가 사용되기 때문이다.
200개 이상이 되는 서로 다른 ATP transport systems는 prokaryotes에서는 동일하게 나타나는데, 이러한 transporter의 구조적 연구는 연관된 protein의 family를 밝히는 것이 그 목적이다.
ABC transporters는 sugars와 amino acids와 같은 organic nutrients를 위해서 존재하는데, 이것 뿐만 아니라 sulfate와 phosphate와 같은 inorganic nutrients와 소량의 금속들을 위해서 존재한다.
ABC type transport systems의 흥미로운 특성 중 하나는 periplasmic-binding proteins의, substrate와 높은 친화력을 갖는다는 점이다.
이 proteins는 periplasms 안에서 움직일 수 있고, substrates의 농도가 매우 낮을 때에도 binding 할 수가 있다. 예를 들어, substrate의 농도가 1 micromolar(10¯6 M) 또는 이것보다 더 작은 농도일 때에도 쉽게 binding 할 수 있고, periplasmic binding proteins에 의해서 옮겨질 수도 있다. 각각의 membrane에 박혀있는 component와 함게 complex가 interacts 하고, ATP의 energy를 사용하여 transport event가 일어나게 된다.
흥미롭게도, Gram positive bacteria 는 periplasm이 없는데도 불구하고, binding protein에 의존하는 transport systems는 이 organisms의 많은 것에서 찾아볼 수 있다. 그러나, Gram positive bacteria에서, 특별한 binding proteins는 cytoplasmic membrane에 박혀있는 상태로 존재한다. 이와는 대조적으로, Gram negative bacteria에서, 이것의 binding protein에 binding 하는 그들의 substrate, 그들은 membrane에 박혀있는 component와 함께 상호작용을 하고, ATP의 사용으로, membrane을 통과하는 transport가 일어난다.
Protein Export
지금까지 우리는 transport의 논의를 small molecules에 초점을 잡아서 설명해 왔다. Proteins같은 large molecules의 transport는 어떻게 일어날까? 적당한 기능을 이용해서, 많은 proteins이 cytoplasmic membrane의 바깥쪽 물질을 옮기기 위해 필요하거나 또는 특별한 방법으로 membrane 안으로 들어올 수 있게 된다.
Prokaryotic cells에서 일어나는 protein translocation은 translocases라고 불리는 proteins의 활성에 츼해서 일어나는데, 이것의 주요 요소중 하나는 Sec(for secretory) system이다.
예를 들어, SecYEG는, membrane에 결합되어진 translocase인데, 이것은 그들의 기능과 함께 특이한 orientation consistent의 membrane 내에서 다른 것들과 inserting 되어 있다.
어떤 translocases는 매우 특이적으로 proteins를 밖으로 내보낼 수도 있지만, 그러나 SecYEG는 prokaryotes사이에서 광범위하게 분포되어 있고, 다양한 서로 다른 proteins를 translocation 할 수 있다.
Protein export는 bacteria에서 매우 중요한데, 그 이유는 많은 bacterial enzymes의 기능에 필요한 것들이 cell 밖에서 많이 생성되기 때문이다(Exoenzymes)
예를 들어, amylase 또는 cellulose 같은 hydrolytic exoenzymes는 그들이 glucose의 연결체인 starch나 cellulos를 분해할 때 cell의 environments에서 연속적으로 분비된다.
이러한 작용은 세포가 탄소를 enzyme source로 이용하기 위해서 일어난다.
무엇보다도, 많은 pathogenic bacteria는 host cell에 들어가 있는 동안 다른 해로운 proteins이나 protein toxins 등을 분비한다.
모든 이러한 large molecules는 cytoplasmic membrane을 통해서 이동하는 데 필요하고, SecYEG 같은 translocases는 이러한 transport가 일어나도록 하는 데 도움을 준다.
※ The cell wall of prokaryotes : Peptidoglycan and related molecules
Bacteria의 세포는 solutes에 용해될 수 있는 물질이 높은 농도로 구성되어 있다. 이러하나 이유에서, E.coli같은 bacterial cell의 2 ,atmospheres정도의 압력이 생기는데, 이것은 tire의 압력과 같다. 이러한 압력에 의해서도 cell이 터지지 않는 이유는 bacteria가 cell walls를 가지고 있기 때문인데, cell wall은 세포의 모양 변화를 막아주고, 세포가 단단할 수 있는 기능을 준다.
우리는 Bacteria에서 gram positive와 gram negative라고 불리는 두 주요 group의 cell wall을 찾아볼 수 있다.
Gram positive와 gram negative 사이의 차이점을 관찰하는 방법으로는 gram stain이 있는데, 그런, cell wall structure의 차이는 gram-staining reaction에 핵심이 있다.
Gram negative cell wall은 여러 개의 층으로 구성된, 완전히 complex된 구조로 되어 있고, 이에 대조적으로, Gram-positive cell wall은 molecule의 single type의 1차 구조로 형성되어 있고 매우 얇다.
Cell wall에 대한 초점은 prokaryotes인 bacteria와 archaea의 cell walls의 polysaccharide component에 맞추고 있다.
Peptidoglycan
Bacteria의 cell walls는 단단한 층으로 구성되어 있는데, 세포벽의 길이를 위하여 1차적으로 필요한 것이다.
Gram negative bacteria에서 추가되는 층은 이 단단한 층의 바깥쪽에서 나타난다.
Gram negative와 gram positive bacteria의 단단한 층은 화학적 구조가 매우 유사하다. Peptidoglycan이라고 불리는, 이 polysaccharide는 두 개의 sugar로 나뉘어질 수 있는데, 이 두 개의 molecules는 N-acetylglucosamine과 N-acetylmuramic acid로 나뉘어질 수 있고, L-alanine, D-alanine, D-glutamic acid와 같은 특이한 amino acids, 그리고 lysine 또는 diaminopimelic aced(DAP) 둘 중 하나를 포함하게 된다.
이 구성 요소들은 glycan tetrapeptide라는 반복되는 구조의 연결로 구성되어 있다.
Peptidoglycan의 기본적인 구조는 cell 주변에 peptidoglycan이 다른 하나와 결합해서 뉘워있는 형태로 구별되서 구성되어 있다. Tetrapeptide cross-links로부터 연결된 sheet form인 glycan chain은 amino acid로 구성되어 있다. Glycan strands의 sugars로 연결된 glycosidic bonds는 매우 강하다. 그러나 이 chains는 혼자 있으면 모든 방향의 단단함을 가질 수 없게 된다.
Peptidogylcan structures의 full strength는 아미노산에 의해서 cross-linked 되어 있다. 이 cross-linking은 서로 다른 bacteria에서 다른 길이로 나타나고, cross-linking이 많이 되면 될수록 더 단단해지고 견고해진다. Gram-negative bacteria에서, cross-linkage는 terminal D-alanine의 carboxyl group에서 diaminopimelic acid의 amino group의 peptide linkage에 의해서 일어난다.
Gram positive bacteria에서, cross-linkage는 peptide interbridge의 방법에 의해서 일어나는데, amino acid의 종류와 수는 organisms에 따라서 매우 다양하게 나타난다. 예를 들어, Staphylococcus aureus, Gram positive bacterium중 가장 잘 연구되어 있는 이것을, 5개의 glycine molecule이 interbridge로 peptide를 구성하고 있다.
Gram-positive bacteria에서 cell wall의 90% 이상은 peptidoglycan으로 구성되어 있고, teichoic acid라고 불리는 다른 molecule은 매우 적은 양만을 찾아볼 수 있다. 그리고 어떤 bacteria에서는 cell을 둘러싸고 있는 peptidoglycan의 single layer로만 구성된 것도 있다. 많은 bacteria, 특히 Gram-positive bacteria는 일반적으로 peptidoglycan의 sheets가 다른 것들과 함께 한 무더기를 만들어 낸다.
Gram-negative bacteria의 cell wall은 오직 10% 만이 peptidoglycan으로 구성되어 있다. 그러나 Gram-positive와 Gram-negative 둘의 세포의 형태는 peptidoglycan chains의 길이에 의해서 그리고 chains의 cross-linking의 길이에 의해서 결정이 된다.
Diversity in Peptidoglycan
Peptidoglycan은 특별한 bacteria에서만 나타난다. Sugar인 N-acetylmuramic acid와 amino acid인 diamino pimelic acid는 Archaea또는 Eukarya의 cell wall에서 찾을 수 있다. 그러나, 모든 bacteria가 그들의 peptidoglycan에 DAP를 가지고 있는 것은 아니다.
모든 Gram-negative bacteria에서 peptidoglycan이 나타나지만 그러나 대부분의 Gram positive cocci는 DAP의 lysine이 대신한다. 그리고 Gram positive bacteria는 다른 amino acid를 갖는다. 다른 흔히 나타나지 않는 peptidogylcan의 두 가지 amino acid가 나타나는데 이것은 D- configuration과 D-alanin 그리고 D-glutamic acid이다.
100가지 이상의 서로 다른 peptidoglycan types가 알려져 있고, 다양한 interbridge를 형성하고 있다.
Glycan portion의 각각의 다른 peptidoglycan structure는 단일 형태이고, sugar인 N-acetylglucosamine과 N-acetylmuramic acid가 나타난다. 이 sugars는 β-1,4 linkage로 연결이 되어 있다.
반복되는 unit의 tetrapeptide는 오직 한 amino acid의 주요 다양성을 보여주고, lysine-diamino pimelic acid가 교대로 나타난다. 그러나, position 2에서 D-glutamic acid가 어떤 organisms에서 hydroxylated로 결합하고, 다른 어떤 것에서는 1,3 position의 amino acid에서 substitutions가 일어난다.
Tetrapeptide에서 나타나는 amino acids의 어떤 것은 interbridge에서 일어날 수 있다. 그러나 추가로, glycine, theonine, serine, 그리고 aspartic acid 같은 amino acid는 interbridge에서 찾을 수 있다. 그러나, branch를 이루고 있는 amino acids, aromatic amino acids, sulfur-containing amino acids, histidine, arginine, 그리고 proline은 interbridge에서 찾을 수 없다.
그러므로, peptidoglycan의 peptide chemisty, peptidoglycan의 backbone - glucosamine과 muramic acid의 반복이 교대로 일어나는 - 은 bacteria의 모든 종에서 동일하게 나타난다.
Teichoic acids is a summary of the Gram-positive wall
많은 Gram-positive bacteria는 그들의 세포벽에 teichoic acids라고 불리는 acidic substances를 가지고 있다. 모든 cell의 wall과 membrane 또는 capsular polymers를 구성하는 glycerophosphate 또는 ribitol phosphate residues가 teichoic acid에 포함된다. 이 polyalcohols는 phosphate seters에 의해서 연결되어 있고, 대게 다른 sugars와 D-alanine이 attached 되어 있다. 왜냐하면 그들은 negative charge를 띄고 있고, teichoic acids는 cell 표면의 negative charge를 위해 필요한 부분이다.
Teichoic acids는 또한 Ca와 Mg같은 2가 양이온을 binding 할 수 있는 기능을 가지고 있다.
이들 중 일부는 cell내로 transported되어진다. 확실한 teichoic acids는 membrane lipids에 covalently bound하고 있고, 이러한 이유에서 이들은 lipoteichoic acids라고 불린다.
Cells with no walls
Peptidoglycan -bacteria의 species의 특징정인 molecule- 은 확실한 작용물질로부터 파괴될 수 있다.
Enzyme인 lysozyme같은 protein은 peptidogylcan의 N-acetylglucosamine과 N-acetylmuramic acid 사이의 β-1,4-glycosidic bonds를 깨주는 역할을 한다. 물이 cell안으로 들어가면, cell이 부풀어 오르고 결과적으로 cell이 터지게 되는데 이러한 과정을 lysis라고 한다. Lysozyme은 tears, saliva, 외 다른 몸의 유동체를 가지고 있는 animal 내에서 찾을 수 있고, bacteria에 의해서 감염이 되면 그 기능이 나타난다.
만약, solute가 세포 내로 들어가지 않으면, sucrose 같은 것을 cell 현탁액에 첨가해 주면, cell 바깥의 solute농도가 내부와 같게 된다(이러한 condition을 isotonic이라고 한다). 이러한 상태 아래에서 lysozyme은 여전히 peptidoglycan을 끊지만, 물이 cell 안으로 들어가지 못해서 cell lysis가 일어나지 않게 된다. 대신에 protoplast(bacteria가 cell wall을 가지고 있지 않은 상태)를 찾을 수 있다. 만약, sucrose에 의해서 안정화된 protoplast가 물 안으로 들어가게 되면 cell lysis가 다시 일어나게 된다. Spheroplast는 protoplast와 함께 사용되는 동의어이지만, 두 단어는 유사하면서도 다른 의미를 가지고 있다.
Protoplasts는 남겨진 cell wall material에서 세포가 자유로워진 것을 이야기하는데 비해 spheroplasts는 wall meterial의 구성 부분이 membrane으로 둘러 쌓인 structrue에 다른 방법으로 attached 되어 있는 것을 이야기한다. 비록, 대부분의 prokaryotes가 그들의 cell wall이 없이 ,자연 상태에서 살아갈 수는 없지만, 일부는 살아갈 수 있다.
Mycoplasmas를 포함하는, infectious diseases의 원인이 되는 group과 thermoplasma group, Archaea는 자연 상태에서 cell wall이 결여되어 있는 상태이다. 이 prokaryotes는 free-living protoplasts이고 cell wall 없이 살아갈 수 있는데 animal body 같은 혀의 membrane 또는 삼투압이 형성될 수 있는 환경에서 살아갈 수 있기 때문이다. Mycoplasmas는 그들의 cell membranes에 sterols를 가지고 있는데 이것의 구조는 단단하고 세기가 강하다.
Pseudopeptidoglycan, S-layers and other cell wall of Archaea
Archaea의 어떤 species는 peptidoglycan과 매우 유사한 polysaccharide로 cell wall이 구성되어 있다. 이러한 materials를 pseudopeptidoglycan이라고 한다. Pseudopeptidoglycan의 backbone은 N-acetylglucosamine과 N-acetyltalosaminuronic acid의 반복으로 구성되어 있다(Peptidoglycan의 N-acetylmuramic acid와 나중에 replaces)
Glycosidic bonds의 peptidoglycan으로부터 나온 β-1,3-bonds로 glycosidic bonds를 형성한다. 다른 Archaea의 세포벽은 peptidoglycan과 pseudopeptidoglycan,
Chemistry of LPS
비록 complex이지만, 일반적 Bacterial로부터 LPS의 화학적 구성 요소는 아직 밝혀지지 않았다.
LPS의 polysaccharide portion은 두 개의 components로 구성이 되는데, core polysaccharide와 O-polysaccharide이다. Salmonella species에서 LPS가 가장 잘 연구가 되어 있는데, ketodeoxyoctonate(KDO)의 구성성분인 core polysaccharide, 7개의 탄소로 구성된 sugar(heptoses), glucose, galactose, 그리고 N-acetylglucosamine 등이 있다. Core의 연결체는 O-specific polysaccharide인데, 이것은 galactose, glucose, rhamnose 그리고 mannose(모두 hexose)로 구성되어 있고, 하나 또는 더 많은 일반적이지 않는 abquose, colitose, paratose 또는 tyvelose같은 dideoxy sugars로 구성되어 있다.
이 sugars는 4개 또는 5개의 membered sequences로 연결되어 있고, 종종 branch를 형성한다. Sequences가 반복될 때, 긴 O-polysaccharide가 형성된다.
Lipopolysaccharide의 lipid portion은, lipid A에 속하는, glycerol lipid는 아니지만, N-acetylglucosamine phosphate의 desaccharide로 구성된 amine ester linkage로부터 연결된 fatty acid로 되어 있다. Disaccharide는 KDO를 통해서 core polysaccharide와 attached 되어 있다.
Fatty acids는 일반적으로 caproic, lauric, myristic, palmitic 그리고 stearic acids등을 포함하는 lipid A에서 찾을 수 있다.
다른 membrane에서 LPS는 membrane의 바깥쪽 소엽 모양의 구조의 protein과 함께 연결되어 있다. A lipoprptein complex는 gram negative bacteria의 number의 LPS의 내부 소엽 모양의 그것과 찾아진다.
Lipoprotein의 기능은 바깥쪽 막과 peptidoglycan사이에 끼어들어가 있다.
마지막으로, outer membrane의 바깥쪽 소엽 모양의 부분은, LPS가 phospholipids와 replaced, 이것은 오직 내부 소엽 모양 부분에서 찾을 수 있다. 그러므로, 바깥쪽 membrane이 lipid bilayer라고 생각될 수도 있지만, 이것의 구조는 cytoplasmic membrane과는 구별되는 구조를 가지고 있다.