Polymerase Chain Reaction (PCR)
중합효소 연쇄반응(Polymerase Chain Reaction, PCR)은 특정 DNA 부위를 특이적으로 반복 합성하여 시험관 내에서 원하는 DNA 분자를 증폭시키는 방법으로서, 아주 적은 양의 DNA를 이용하여 많은 양의 DNA 합성이 가능하므로 분자 생물학적으로 제한효소의 발견만큼 획기적인 것이라고 할 수 있다. 즉 genomic DNA와 같은 아주 큰 DNA로부터 원하는 DNA 부분만을 선택적으로 증폭시킨 후 일반적으로 사용되는 agarose gel이나 polyacrylamide gel 상에서 뚜렷하게 보이는 band로 가시화할 수가 있다.
중합효소 연쇄반응을 통하여 in vitro 상에서 특정 부위의 DNA를 10의 5~10의 8배까지 수시간내에 증폭시킬 수 있으며, 이렇게 증폭된 DNA를 다음과 같이 여러 가지 실험에 이용할 수 있고, 실험 결과를 토대로 여러 의학적인 연구에 응용할 수가 있다.
중합효소 연쇄반응이 이용되는 실험
1) Probe로 사용할 목적으로 cloning된 이중가닥 DNA의 증폭
2) 적은 양의 mRNA로부터 특정 cDNA의 cloninig
3) DNA sequencing
4) 돌연변이 검사
5) 병인성 바이러스 및 박테리아 검출
6) 유전자 footprinting
7) 특정 부위에 돌연변이를 일으킨 유전자의 제조 (site directed mutagenesis)
중합효소 연쇄반응의 의학적 응용
1) HLA형의 결정
2) 법의학 : 특정인의 유전자 검출
3) 암유전자의 검출 : ras, myc, fos 등
4) 유전자 질병의 진단 : Progressive muscular dystrophy (Duchenne type) 등
5) 감염성 질병의 진단 : Streptococcus, Salmonella, Hepatitis virus 등
중합효소 연쇄반응은 다음과 같이 세 단계로 이루어진다.
1) DNA의 변성 (denaturation)
90도씨에서 96도씨로 가열하여 double strand DNA (ds DNA)를 single strand DNA (ssDNA) 로 분리시킨다. 높은 온도일수록 ssDNA로 잘 이행되지만 Taq polymerase도 온도가 아주 높은 상태에서는 활성도가 낮아질 수 있으므로 보통 94도씨로 쓴다. Cycle의 처음은 확실한 변성을 위하여 약 5분간 시간을 주어야 한다.
2) Primer의 결합 (annealing)
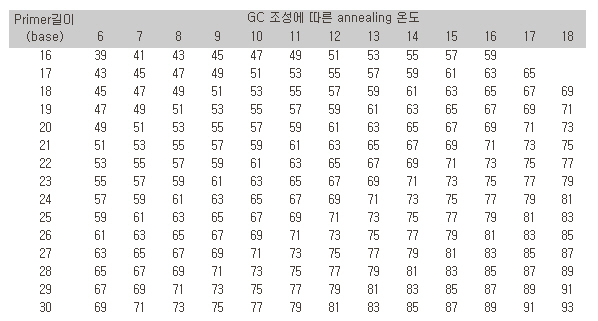
50~65도씨에서 진행되며, 염기간에 G와 C는 세 군데에서 수소결합이 일어나고, A와 T는 두 군데에서 결합이 일어나므로 G+C 비율에 따라 결합온도에 변화를 주어야 한다. 일반적으로 사용되는 annealing 온도는 다음 표와 같다. 비특이 PCR 산물이 형성되는 경우 결합 온도를 올려서 반응시켜 보면 비특이 산물을 줄이는데 도움이 되는 수가 있다.
<표. Primer 길이와 조성에 따른 annealing 온도>
3) DNA의 합성 (polymerization)
70~74도씨에서 시행하며 원하는 PCR 산물의 크기가 크거나 반응요소의 농도가 낮을 때에는 시간을 연장시키는 것이 좋다. Taq polmerase는 보통 1분에 2000~4000 nucleotides를 합성할 수 있으므로 원하는 PCR 산물의 크기가 1kb마다 1분 정도의 시간을 배당하면 충분히 반응이 일어날 수 있다. Cycle이 계속 되면서 효소 활성이 감소할 수 있고 DNA 산물은 점점 많이 존재하게 되므로 cycle 후반부에는 반응 시간을 조금씩 늘려 가는 것도 좋은 방법의 하나이며, 마지막 cycle에는 시간을 충분히 (10분) 주어 효소의 활성이 충분히 발휘되도록 한다.
위 과정이 계속 반복하여 진행되면서 (보통 25회~35회) 원하는 DNA 부분을 증폭시키는 것이 중합효소 연쇄반응의 원리이다.
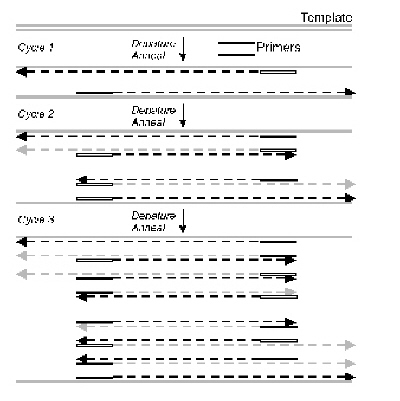
A. Genomic DNA로부터 특정 유전자 부위의 증폭
실험 방법
1. 실험에 이용할 PCR 시험관에 다음과 같이 실험에 사용할 재료들을 혼합하고 pipette으로 잘 섞는다.
Template DNA (100ng/ml) 1ul
Upstream primer (12.5pmole/ul) 1ul
Downstream primer (12.5pmole/ul) 1ul
dNTP (dA, dC, dG, dT 2.5mM-each) 2ul
10x PCR 완충용액 5ul
증류수 12.5pmole/ul) 1ul
Tap DNA polymerase (1 unit/ul) 1ul (총 부피 50ul)
- 10x PCR 완충용액 (100mM Tris-Cl, pH 8.3, 500mM KCl, 15~20 mM magnesium chloride, 0.01 % gelatin 또는 bovine serum albumin [BSA])은 효소에 딸려오는 것을 사용하면 되지만, MgCl2 농도를 변화시킬 필요가 있는 경우에는 Mg-free 완충용액을 사용해야 한다.
- 여러 명의 다른 환자 혈액에서 분리한 template와 같은 primer로 증폭하려 할 때에는 template를 제외한 다른 성분을 한꺼번에 섞은 PCR mix를 만들어서 쓰면 좋다.
- 위 반응은 단지 예일 뿐이며 모든 성문은 PCR 반응마다 여러번 실험을 반복하면서 최적 조건을 결정하여 사용해야 한다. 각 조성마다 고려해야 할 점과 주의 사항은 아래에 따로 정리하였다.
- 최근에 나오는 PCR 기계에 맞는 PCR 시험관은 크기가 작고 얇아서 열 전도가 잘 되도록 된 것이다. 작아서 다루기는 어렵고 비싸지만 반응이 잘 일어나기 때문에 많이 쓰인다.
- 중합효소 연쇄반응은 대단히 민감한 반응이다. 위의 여러가지 시약들이 조금이라도 다른 물질에 오염되거나 더러운 tip을 쓰는 경우 false positive 반응이 나오는 확률이 아주 높으므로 반드시 깨끗한 시약을 조금씩 덜어서 쓰도록 하고 오염이 의심되면 버려야 한다.
2. 혼합한 시료를 PCR 기계에 넣고 다음과 같은 프로그램으로 PCR을 시작한다.
| Denature | Annealing | Polymerization | Cycle 수 | |
| Cycle1 | 94도씨, 5분 | 60도씨 30초 | 72도씨 30초 | 1 cycle |
| Cycle2 | 94도씨, 30초 | 60도씨 30초 | 72도씨 30초 | 30 cycles |
| Cycle3 | 94도씨, 30초 | 60도씨 30초 | 72도씨 10분 | 1 cycle |
- 위 반응은 단지 예일 뿐이며 annealing 온도와 각 시간은 PCR 반응마다 여러번 실험을 반복하면서 최적 조건을 결정하여 사용해야 한다.
- 옛날에는 혼합액 위에 증발을 방지하기 위해서 mineral oil을 얹어야 했지만, 최근의 많은 기계와 시험관은 이런 과정이 필요없도록 뚜껑 쪽에서 가열하게 되어 있다.
3. 반응이 끝나면 10~20ul 정도 반응액으로 전기영동을 실시하여 반응 산물을 확인한다.
- 반응 산물을 확인하기 위해서는 acrylamide gel 보다 사용하기 편리한 agarose gel을 더 많이 이용한다. 그러나, 100bp 이하의 반응 산물을 확인해야 할 경우에는 agarose gel 상에서 구별이 어려운 경우가 있으므로 acrylamide gel (12%)을 사용하면 더 분명하게 확인할 수 있다.