Difference between revisions of "PCR (Polymerase Chain Reaction)"
| (3 intermediate revisions by the same user not shown) | |||
| Line 46: | Line 46: | ||
위 과정이 계속 반복하여 진행되면서 (보통 25회~35회) 원하는 DNA 부분을 증폭시키는 것이 중합효소 연쇄반응의 원리이다.<br /> | 위 과정이 계속 반복하여 진행되면서 (보통 25회~35회) 원하는 DNA 부분을 증폭시키는 것이 중합효소 연쇄반응의 원리이다.<br /> | ||
<br /> | <br /> | ||
| − | [[image : genomic.jpg]]</font></p> | + | [[image : genomic.jpg]]<br /> |
| + | <br /> | ||
| + | <strong><br /> | ||
| + | <font style="BACKGROUND-COLOR: #ffff99">A. Genomic DNA로부터 특정 유전자 부위의 증폭</font></strong><br /> | ||
| + | <br /> | ||
| + | <strong>실험 방법</strong><br /> | ||
| + | <br /> | ||
| + | 1. 실험에 이용할 PCR 시험관에 다음과 같이 실험에 사용할 재료들을 혼합하고 pipette으로 잘 섞는다.<br /> | ||
| + | <br /> | ||
| + | Template DNA (100ng/ml) <strong>1ul</strong><br /> | ||
| + | Upstream primer (12.5pmole/ul) <strong>1ul<br /> | ||
| + | </strong>Downstream primer (12.5pmole/ul)<strong> 1ul<br /> | ||
| + | </strong>dNTP (dA, dC, dG, dT 2.5mM-each) <strong>2ul</strong><br /> | ||
| + | 10x PCR 완충용액 <strong>5ul</strong><br /> | ||
| + | 증류수 12.5pmole/ul) <strong>1ul</strong><br /> | ||
| + | Tap DNA polymerase (1 unit/ul) <strong>1ul</strong> (총 부피 <strong>50ul</strong>)<br /> | ||
| + | <br /> | ||
| + | * 10x PCR 완충용액 (100mM Tris-Cl, pH 8.3, 500mM KCl, 15~20 mM magnesium chloride, 0.01 % gelatin 또는 bovine serum albumin [BSA])은 효소에 딸려오는 것을 사용하면 되지만, MgCl2 농도를 변화시킬 필요가 있는 경우에는 Mg-free 완충용액을 사용해야 한다.<br /> | ||
| + | <br /> | ||
| + | * 여러 명의 다른 환자 혈액에서 분리한 template와 같은 primer로 증폭하려 할 때에는 template를 제외한 다른 성분을 한꺼번에 섞은 PCR mix를 만들어서 쓰면 좋다.<br /> | ||
| + | <br /> | ||
| + | * 위 반응은 단지 예일 뿐이며 모든 성문은 PCR 반응마다 여러번 실험을 반복하면서 최적 조건을 결정하여 사용해야 한다. 각 조성마다 고려해야 할 점과 주의 사항은 아래에 따로 정리하였다.<br /> | ||
| + | <br /> | ||
| + | * 최근에 나오는 PCR 기계에 맞는 PCR 시험관은 크기가 작고 얇아서 열 전도가 잘 되도록 된 것이다. 작아서 다루기는 어렵고 비싸지만 반응이 잘 일어나기 때문에 많이 쓰인다.<br /> | ||
| + | <br /> | ||
| + | * 중합효소 연쇄반응은 대단히 민감한 반응이다. 위의 여러가지 시약들이 조금이라도 다른 물질에 오염되거나 더러운 tip을 쓰는 경우 false positive 반응이 나오는 확률이 아주 높으므로 반드시 깨끗한 시약을 조금씩 덜어서 쓰도록 하고 오염이 의심되면 버려야 한다.<br /> | ||
| + | <br /> | ||
| + | <br /> | ||
| + | 2. 혼합한 시료를 PCR 기계에 넣고 다음과 같은 프로그램으로 PCR을 시작한다.<br /> | ||
| + | <br /> | ||
| + | <table cellspacing="1" cellpadding="1" width="200" summary="" border="1"> | ||
| + | <tbody> | ||
| + | <tr> | ||
| + | </tr> | ||
| + | <tr> | ||
| + | </tr> | ||
| + | <tr> | ||
| + | </tr> | ||
| + | <tr> | ||
| + | </tr> | ||
| + | </tbody> | ||
| + | </table> | ||
| + | <table style="WIDTH: 651px; HEIGHT: 83px" cellspacing="1" cellpadding="1" width="651" summary="" border="1"> | ||
| + | <tbody> | ||
| + | <tr> | ||
| + | <td bgcolor="#cccccc"> </td> | ||
| + | <td bgcolor="#cccccc"><strong> Denature</strong></td> | ||
| + | <td bgcolor="#cccccc"><strong> Annealing</strong></td> | ||
| + | <td bgcolor="#cccccc"><strong> Polymerization</strong></td> | ||
| + | <td bgcolor="#cccccc"><strong> Cycle 수</strong></td> | ||
| + | </tr> | ||
| + | <tr> | ||
| + | <td><strong> Cycle1</strong></td> | ||
| + | <td> 94도씨, 5분</td> | ||
| + | <td> 60도씨 30초</td> | ||
| + | <td> 72도씨 30초</td> | ||
| + | <td> 1 cycle </td> | ||
| + | </tr> | ||
| + | <tr> | ||
| + | <td><strong> Cycle2</strong></td> | ||
| + | <td> 94도씨, 30초</td> | ||
| + | <td> 60도씨 30초</td> | ||
| + | <td> 72도씨 30초</td> | ||
| + | <td> 30 cycles</td> | ||
| + | </tr> | ||
| + | <tr> | ||
| + | <td><strong> Cycle3</strong></td> | ||
| + | <td> 94도씨, 30초</td> | ||
| + | <td> 60도씨 30초</td> | ||
| + | <td> 72도씨 10분</td> | ||
| + | <td> 1 cycle</td> | ||
| + | </tr> | ||
| + | </tbody> | ||
| + | </table> | ||
| + | <br /> | ||
| + | * 위 반응은 단지 예일 뿐이며 annealing 온도와 각 시간은 PCR 반응마다 여러번 실험을 반복하면서 최적 조건을 결정하여 사용해야 한다.<br /> | ||
| + | <br /> | ||
| + | * 옛날에는 혼합액 위에 증발을 방지하기 위해서 mineral oil을 얹어야 했지만, 최근의 많은 기계와 시험관은 이런 과정이 필요없도록 뚜껑 쪽에서 가열하게 되어 있다.<br /> | ||
| + | <br /> | ||
| + | <br /> | ||
| + | 3. 반응이 끝나면 10~20ul 정도 반응액으로 전기영동을 실시하여 반응 산물을 확인한다.<br /> | ||
| + | <br /> | ||
| + | * 반응 산물을 확인하기 위해서는 acrylamide gel 보다 사용하기 편리한 agarose gel을 더 많이 이용한다. 그러나, 100bp 이하의 반응 산물을 확인해야 할 경우에는 agarose gel 상에서 구별이 어려운 경우가 있으므로 acrylamide gel (12%)을 사용하면 더 분명하게 확인할 수 있다.<br /> | ||
| + | <br /> | ||
| + | <br /> | ||
| + | <strong># PCR 반응 각 성분에 대해 고려할 점 <br /> | ||
| + | </strong><br /> | ||
| + | <strong><font style="BACKGROUND-COLOR: #ffff00">1. Template DNA<br /> | ||
| + | </font></strong><br /> | ||
| + | 선택하여 증폭하고자 하는 target DNA 단편을 가리키는 용어로서 세포내의 chromosomal DNA나 전염성 병우너체의 DNA 또는 RNA로부터 제조한 complementary DNA (cDNA), plasmid DNA 등을 쓸 수 있다. 불순물이 섞여 있으면 반응을 억제할 수 있으므로 가능한 한 정제하여 사용하는 것이 좋으며, 정제가 안된 경우에는 양이 적을 대 만응이 충분히 일어나지 않고 양이 많으면 비특이적 반응이 일어나므로 주의햐여 한다.<br /> | ||
| + | Chromosomal DNA인 경우 1ug 이내, plasmid DNA의 경우 100pg~100ng 정도를 일반적으로 사용하지만 사용하고자 하는 DNA 내에 증폭하고자 하는 target DNA의 copy 수에 따라 달라질 수 있다. 전기영동상에서 비특이 DNA가 나타나거나 끌린 모양이 나타나면 맨 먼저 template DNA 양을 줄이는 것을 시도하는 것이 좋다.<br /> | ||
| + | <br /> | ||
| + | <strong><br /> | ||
| + | <font style="BACKGROUND-COLOR: #ffff00">2. Primer</font></strong><br /> | ||
| + | <br /> | ||
| + | Template DNA 가운데 선택적으로 증폭시키고자 하는 target DNA 단편의 양쪽 끝에서 안쪽으로 약 20bp 내외의 염기서열에 대응하는 pligonucleotide를 DNA 합성기로 합성하여 이용한다.<br /> | ||
| + | G+C 비율이 반 정도 되게 디자인하는 것이 primer와 template 간의 결합력을 강하게 유지하는 데 도움이 되며 G+C 함량이 많을 경우에는 annealing 온도를 높이면 되지만, 무엇보다도 양쪽 primer의 annealing 온도를 비슷하게 만들어야 한다. 또한 양쪽 primer가 서로 상보적인 염기 결합이 일어나지 않도록 하고 가능하면 반응산물내에 있는 DNA 염기서열을 분석하여 비특이 DNA가 생성되지 않고록 고안해야 한다. Primer의 디자인이 PCR 반응의 성공 유무의 90%를 차지한다고 할 수 있기 때문에 합성하기 전에 신중히 고려해야 할 것이다. Primer의 합성은 염기서열을 적어 회사에 의뢰하면 주문에 따라서 정제도 해준다. 정제는 Sep-pak, OPC나 PAGE 정제를 이용하는데, 가능하면 PAGE 정제된 primer를 쓰도록 한다.<br /> | ||
| + | Primer의 양은 0.1~0.5uM로 시행한다.<br /> | ||
| + | <br /> | ||
| + | <br /> | ||
| + | <strong><font style="BACKGROUND-COLOR: #ffff00">3. dNTP (deoxynucleotide triphosphate)</font><br /> | ||
| + | </strong><br /> | ||
| + | 시약상에서 dATP, dCTP, dGTP와 dTTP (각각 100mM stock)을 구입한 후 혼합하여 사용한다. 양은 target DNA의 길이에 따라 다를 수 있으나 각각 20~200 uM 정도를 사용한다.<br /> | ||
| + | <br /> | ||
| + | <br /> | ||
| + | <strong><font style="BACKGROUND-COLOR: #ffff00">4. 10x PCR 완충용액</font><br /> | ||
| + | </strong><br /> | ||
| + | 1) Magenesium<br /> | ||
| + | <br /> | ||
| + | 다음과 같은 여러 가지에 영향을 주는 중요한 요소이다.<br /> | ||
| + | A. Primer가 template DNA에 결합하는 능력<br /> | ||
| + | B. Template 및 PCR 산물의 변성온도<br /> | ||
| + | C. Product specificity<br /> | ||
| + | D. dNTP와의 결합<br /> | ||
| + | E. Taq polymerase의 활동성<br /> | ||
| + | F. Primer-dimer artefact의 형성<br /> | ||
| + | <br /> | ||
| + | a) 반응물 내에 EDTA와 같은 chelator가 포함되면 농도를 올려주어야 하고, dNTP나 template의 농도가 높으면 MgCl2의 농도를 높게 변화시켜야 한다.<br /> | ||
| + | b) 위에 나열한 Mg의 기능중 A, B, C, D는 농도가 높을수록 실험에 유익하고 E, F는 농도가 낮을수록 실험에 유익하므로 최적 농도를 유지할 수 있도록 노력해야 한다.<br /> | ||
| + | c) 반응이 잘 일어나지 않으면 0.5mM부터 2.5mM (때로는 8mM까지) 사이에서 농도를 변화시켜 가면서 최적조건을 찾도록 한다.<br /> | ||
| + | <br /> | ||
| + | 2) KCl<br /> | ||
| + | <br /> | ||
| + | Primer가 target DNA에 결합하는 것을 도와주며, Taq DNA polymerase의 반응율을 높여준다.<br /> | ||
| + | <br /> | ||
| + | 3) Gelatin 또는 bovine serum albumin (BSA)<br /> | ||
| + | <br /> | ||
| + | Taq DNA polymerase를 안정화한다.<br /> | ||
| + | * 일부 보고에 의하면 반응완충용액 내에 KCl이나 gelatin, BSA 등을 첨가하지 않는 것이 더 좋다는 설도 있다.<br /> | ||
| + | <br /> | ||
| + | <br /> | ||
| + | <font style="BACKGROUND-COLOR: #ffff00"><strong>5. Taq DNA polymerase</strong><br /> | ||
| + | </font><br /> | ||
| + | Taq는 온천에서 사는 Thermus aquaticus 라는 균주에서 따온 이름이다. 이 균의 활동 적정온도는 70~74 도씨이며, 95도씨에서 40분이 지나도 50% 정도의 활성은 남아 있다. 이 효소가 발견되기 전에는 Klenow 효소를 이용하여 매 cycle마다 효소를 첨가해 주면서 반응을 시켜야만 했다.<br /> | ||
| + | <br /> | ||
| + | DNA 합성의 오차율은 1.1*10의 -4 제곱 bp로 DNA polymerase I의 오차률 (1.0*10의 -5제곱) 보다 높은데 이는 Taq DNA polymerase가 잘못 들어간 nucleotide를 삭제하고 다시 합성하는 proofreading 기능 (3번 -> 5번 방향 exonuclease activity)이 없기 때문이다. 따라서 PCR 산물에서 유전자의 변이가 발견되더라도 반드시 확인 과정을 거쳐야 한다.<br /> | ||
| + | <br /> | ||
| + | 한 번의 반응에 사용하는 효소의 양은 보통 0.5~5 unit 정도인데 양이 너무 많으면 비특이적인 DNA가 형성될 가능성이 많고, 너무 적으면 증폭 산물이 부족하게 되므로 최적 조건을 찾도록 노력해야 한다.<br /> | ||
| + | <br /> | ||
| + | </font></p> | ||
Latest revision as of 21:52, 14 November 2006
Polymerase Chain Reaction (PCR)
중합효소 연쇄반응(Polymerase Chain Reaction, PCR)은 특정 DNA 부위를 특이적으로 반복 합성하여 시험관 내에서 원하는 DNA 분자를 증폭시키는 방법으로서, 아주 적은 양의 DNA를 이용하여 많은 양의 DNA 합성이 가능하므로 분자 생물학적으로 제한효소의 발견만큼 획기적인 것이라고 할 수 있다. 즉 genomic DNA와 같은 아주 큰 DNA로부터 원하는 DNA 부분만을 선택적으로 증폭시킨 후 일반적으로 사용되는 agarose gel이나 polyacrylamide gel 상에서 뚜렷하게 보이는 band로 가시화할 수가 있다.
중합효소 연쇄반응을 통하여 in vitro 상에서 특정 부위의 DNA를 10의 5~10의 8배까지 수시간내에 증폭시킬 수 있으며, 이렇게 증폭된 DNA를 다음과 같이 여러 가지 실험에 이용할 수 있고, 실험 결과를 토대로 여러 의학적인 연구에 응용할 수가 있다.
중합효소 연쇄반응이 이용되는 실험
1) Probe로 사용할 목적으로 cloning된 이중가닥 DNA의 증폭
2) 적은 양의 mRNA로부터 특정 cDNA의 cloninig
3) DNA sequencing
4) 돌연변이 검사
5) 병인성 바이러스 및 박테리아 검출
6) 유전자 footprinting
7) 특정 부위에 돌연변이를 일으킨 유전자의 제조 (site directed mutagenesis)
중합효소 연쇄반응의 의학적 응용
1) HLA형의 결정
2) 법의학 : 특정인의 유전자 검출
3) 암유전자의 검출 : ras, myc, fos 등
4) 유전자 질병의 진단 : Progressive muscular dystrophy (Duchenne type) 등
5) 감염성 질병의 진단 : Streptococcus, Salmonella, Hepatitis virus 등
중합효소 연쇄반응은 다음과 같이 세 단계로 이루어진다.
1) DNA의 변성 (denaturation)
90도씨에서 96도씨로 가열하여 double strand DNA (ds DNA)를 single strand DNA (ssDNA) 로 분리시킨다. 높은 온도일수록 ssDNA로 잘 이행되지만 Taq polymerase도 온도가 아주 높은 상태에서는 활성도가 낮아질 수 있으므로 보통 94도씨로 쓴다. Cycle의 처음은 확실한 변성을 위하여 약 5분간 시간을 주어야 한다.
2) Primer의 결합 (annealing)
50~65도씨에서 진행되며, 염기간에 G와 C는 세 군데에서 수소결합이 일어나고, A와 T는 두 군데에서 결합이 일어나므로 G+C 비율에 따라 결합온도에 변화를 주어야 한다. 일반적으로 사용되는 annealing 온도는 다음 표와 같다. 비특이 PCR 산물이 형성되는 경우 결합 온도를 올려서 반응시켜 보면 비특이 산물을 줄이는데 도움이 되는 수가 있다.
<표. Primer 길이와 조성에 따른 annealing 온도>
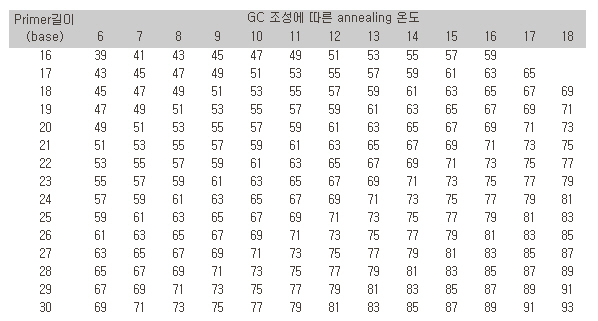
3) DNA의 합성 (polymerization)
70~74도씨에서 시행하며 원하는 PCR 산물의 크기가 크거나 반응요소의 농도가 낮을 때에는 시간을 연장시키는 것이 좋다. Taq polmerase는 보통 1분에 2000~4000 nucleotides를 합성할 수 있으므로 원하는 PCR 산물의 크기가 1kb마다 1분 정도의 시간을 배당하면 충분히 반응이 일어날 수 있다. Cycle이 계속 되면서 효소 활성이 감소할 수 있고 DNA 산물은 점점 많이 존재하게 되므로 cycle 후반부에는 반응 시간을 조금씩 늘려 가는 것도 좋은 방법의 하나이며, 마지막 cycle에는 시간을 충분히 (10분) 주어 효소의 활성이 충분히 발휘되도록 한다.
위 과정이 계속 반복하여 진행되면서 (보통 25회~35회) 원하는 DNA 부분을 증폭시키는 것이 중합효소 연쇄반응의 원리이다.
A. Genomic DNA로부터 특정 유전자 부위의 증폭
실험 방법
1. 실험에 이용할 PCR 시험관에 다음과 같이 실험에 사용할 재료들을 혼합하고 pipette으로 잘 섞는다.
Template DNA (100ng/ml) 1ul
Upstream primer (12.5pmole/ul) 1ul
Downstream primer (12.5pmole/ul) 1ul
dNTP (dA, dC, dG, dT 2.5mM-each) 2ul
10x PCR 완충용액 5ul
증류수 12.5pmole/ul) 1ul
Tap DNA polymerase (1 unit/ul) 1ul (총 부피 50ul)
- 10x PCR 완충용액 (100mM Tris-Cl, pH 8.3, 500mM KCl, 15~20 mM magnesium chloride, 0.01 % gelatin 또는 bovine serum albumin [BSA])은 효소에 딸려오는 것을 사용하면 되지만, MgCl2 농도를 변화시킬 필요가 있는 경우에는 Mg-free 완충용액을 사용해야 한다.
- 여러 명의 다른 환자 혈액에서 분리한 template와 같은 primer로 증폭하려 할 때에는 template를 제외한 다른 성분을 한꺼번에 섞은 PCR mix를 만들어서 쓰면 좋다.
- 위 반응은 단지 예일 뿐이며 모든 성문은 PCR 반응마다 여러번 실험을 반복하면서 최적 조건을 결정하여 사용해야 한다. 각 조성마다 고려해야 할 점과 주의 사항은 아래에 따로 정리하였다.
- 최근에 나오는 PCR 기계에 맞는 PCR 시험관은 크기가 작고 얇아서 열 전도가 잘 되도록 된 것이다. 작아서 다루기는 어렵고 비싸지만 반응이 잘 일어나기 때문에 많이 쓰인다.
- 중합효소 연쇄반응은 대단히 민감한 반응이다. 위의 여러가지 시약들이 조금이라도 다른 물질에 오염되거나 더러운 tip을 쓰는 경우 false positive 반응이 나오는 확률이 아주 높으므로 반드시 깨끗한 시약을 조금씩 덜어서 쓰도록 하고 오염이 의심되면 버려야 한다.
2. 혼합한 시료를 PCR 기계에 넣고 다음과 같은 프로그램으로 PCR을 시작한다.
| Denature | Annealing | Polymerization | Cycle 수 | |
| Cycle1 | 94도씨, 5분 | 60도씨 30초 | 72도씨 30초 | 1 cycle |
| Cycle2 | 94도씨, 30초 | 60도씨 30초 | 72도씨 30초 | 30 cycles |
| Cycle3 | 94도씨, 30초 | 60도씨 30초 | 72도씨 10분 | 1 cycle |
- 위 반응은 단지 예일 뿐이며 annealing 온도와 각 시간은 PCR 반응마다 여러번 실험을 반복하면서 최적 조건을 결정하여 사용해야 한다.
- 옛날에는 혼합액 위에 증발을 방지하기 위해서 mineral oil을 얹어야 했지만, 최근의 많은 기계와 시험관은 이런 과정이 필요없도록 뚜껑 쪽에서 가열하게 되어 있다.
3. 반응이 끝나면 10~20ul 정도 반응액으로 전기영동을 실시하여 반응 산물을 확인한다.
- 반응 산물을 확인하기 위해서는 acrylamide gel 보다 사용하기 편리한 agarose gel을 더 많이 이용한다. 그러나, 100bp 이하의 반응 산물을 확인해야 할 경우에는 agarose gel 상에서 구별이 어려운 경우가 있으므로 acrylamide gel (12%)을 사용하면 더 분명하게 확인할 수 있다.
# PCR 반응 각 성분에 대해 고려할 점
1. Template DNA
선택하여 증폭하고자 하는 target DNA 단편을 가리키는 용어로서 세포내의 chromosomal DNA나 전염성 병우너체의 DNA 또는 RNA로부터 제조한 complementary DNA (cDNA), plasmid DNA 등을 쓸 수 있다. 불순물이 섞여 있으면 반응을 억제할 수 있으므로 가능한 한 정제하여 사용하는 것이 좋으며, 정제가 안된 경우에는 양이 적을 대 만응이 충분히 일어나지 않고 양이 많으면 비특이적 반응이 일어나므로 주의햐여 한다.
Chromosomal DNA인 경우 1ug 이내, plasmid DNA의 경우 100pg~100ng 정도를 일반적으로 사용하지만 사용하고자 하는 DNA 내에 증폭하고자 하는 target DNA의 copy 수에 따라 달라질 수 있다. 전기영동상에서 비특이 DNA가 나타나거나 끌린 모양이 나타나면 맨 먼저 template DNA 양을 줄이는 것을 시도하는 것이 좋다.
2. Primer
Template DNA 가운데 선택적으로 증폭시키고자 하는 target DNA 단편의 양쪽 끝에서 안쪽으로 약 20bp 내외의 염기서열에 대응하는 pligonucleotide를 DNA 합성기로 합성하여 이용한다.
G+C 비율이 반 정도 되게 디자인하는 것이 primer와 template 간의 결합력을 강하게 유지하는 데 도움이 되며 G+C 함량이 많을 경우에는 annealing 온도를 높이면 되지만, 무엇보다도 양쪽 primer의 annealing 온도를 비슷하게 만들어야 한다. 또한 양쪽 primer가 서로 상보적인 염기 결합이 일어나지 않도록 하고 가능하면 반응산물내에 있는 DNA 염기서열을 분석하여 비특이 DNA가 생성되지 않고록 고안해야 한다. Primer의 디자인이 PCR 반응의 성공 유무의 90%를 차지한다고 할 수 있기 때문에 합성하기 전에 신중히 고려해야 할 것이다. Primer의 합성은 염기서열을 적어 회사에 의뢰하면 주문에 따라서 정제도 해준다. 정제는 Sep-pak, OPC나 PAGE 정제를 이용하는데, 가능하면 PAGE 정제된 primer를 쓰도록 한다.
Primer의 양은 0.1~0.5uM로 시행한다.
3. dNTP (deoxynucleotide triphosphate)
시약상에서 dATP, dCTP, dGTP와 dTTP (각각 100mM stock)을 구입한 후 혼합하여 사용한다. 양은 target DNA의 길이에 따라 다를 수 있으나 각각 20~200 uM 정도를 사용한다.
4. 10x PCR 완충용액
1) Magenesium
다음과 같은 여러 가지에 영향을 주는 중요한 요소이다.
A. Primer가 template DNA에 결합하는 능력
B. Template 및 PCR 산물의 변성온도
C. Product specificity
D. dNTP와의 결합
E. Taq polymerase의 활동성
F. Primer-dimer artefact의 형성
a) 반응물 내에 EDTA와 같은 chelator가 포함되면 농도를 올려주어야 하고, dNTP나 template의 농도가 높으면 MgCl2의 농도를 높게 변화시켜야 한다.
b) 위에 나열한 Mg의 기능중 A, B, C, D는 농도가 높을수록 실험에 유익하고 E, F는 농도가 낮을수록 실험에 유익하므로 최적 농도를 유지할 수 있도록 노력해야 한다.
c) 반응이 잘 일어나지 않으면 0.5mM부터 2.5mM (때로는 8mM까지) 사이에서 농도를 변화시켜 가면서 최적조건을 찾도록 한다.
2) KCl
Primer가 target DNA에 결합하는 것을 도와주며, Taq DNA polymerase의 반응율을 높여준다.
3) Gelatin 또는 bovine serum albumin (BSA)
Taq DNA polymerase를 안정화한다.
- 일부 보고에 의하면 반응완충용액 내에 KCl이나 gelatin, BSA 등을 첨가하지 않는 것이 더 좋다는 설도 있다.
5. Taq DNA polymerase
Taq는 온천에서 사는 Thermus aquaticus 라는 균주에서 따온 이름이다. 이 균의 활동 적정온도는 70~74 도씨이며, 95도씨에서 40분이 지나도 50% 정도의 활성은 남아 있다. 이 효소가 발견되기 전에는 Klenow 효소를 이용하여 매 cycle마다 효소를 첨가해 주면서 반응을 시켜야만 했다.
DNA 합성의 오차율은 1.1*10의 -4 제곱 bp로 DNA polymerase I의 오차률 (1.0*10의 -5제곱) 보다 높은데 이는 Taq DNA polymerase가 잘못 들어간 nucleotide를 삭제하고 다시 합성하는 proofreading 기능 (3번 -> 5번 방향 exonuclease activity)이 없기 때문이다. 따라서 PCR 산물에서 유전자의 변이가 발견되더라도 반드시 확인 과정을 거쳐야 한다.
한 번의 반응에 사용하는 효소의 양은 보통 0.5~5 unit 정도인데 양이 너무 많으면 비특이적인 DNA가 형성될 가능성이 많고, 너무 적으면 증폭 산물이 부족하게 되므로 최적 조건을 찾도록 노력해야 한다.